Ниже рассматриваются вопросы, связанные с подготовкой и получением некоторых керамических ториевых соединений, их ядерные и физические свойства как топлива для ядерных реакторов.
- Оксиды, карбиды, нитриды и сульфиды тория. Оксиды. Торий образует два оксидных соединения: ThO2 и ThO. Наиболее распространенным является ThO2 (диоксид тория), природный материал, имеющий кубическую модификацию кристаллической структуры фторидного типа. Диоксид тория имеет температуру плавления около 3000 °С и не подвержен легкому разложению. Плотность ThO2 составляет 11,39 г/см3 при комнатной температуре. Монооксид ThO имеет структуру типа NaCi.
Диоксид тория можно получить прокаливанием тория в среде кислорода, прокаливанием гидроокиси Th(OH)4 и прокаливанием соли тория в щавелевой кислоте или кальцинированием оксалата тория, т.е. Th(C2O4)2 — 6H2O. Аморфный диоксид также можно получить в кристаллической форме плавлением с бурой. Плавление с фосфатом калия дает кристалл, который относится к кубическим системам. Диоксид тория ThO2 относится к наиболее тугоплавким соединениям и в сочетании с оксидами урана UO2 и плутония PuO2 может служить топливом ядерных реакторов, являясь смесью делящихся и сырьевых нуклидов.
Карбиды. Металлический торий может легко взаимодействовать с графитом при высоких температурах с образованием монокарбида ThC и дикарбида ThC2.ThC, ThC2 и Th2С3 могут также быть получены нагреванием ThO2 и графита в электрических или индукционных тиглях (печах):
![]() (9.5)
(9.5)
При недостатке углерода возможна реакция:
![]() (9.6)
(9.6)
ThC2 горит ярко в воздухе (образуя диоксид) и гидролизуется в воде или сыром воздухе с образованием смеси гидрокарбидов.
При нагревании ThC2 взаимодействует с галогенами с образованием соответствующих ангидридов солей и с серой с образованием сульфида Th, ThC образует соединения с UC или PuC, которые могут быть использованы как карбидное ядерное топливо, содержащее сырьевые и делящиеся компоненты.
Нитриды. Торий взаимодействует с азотом и образует два нитрида: ThN и Th2N3. ThN имеет структуру типа FCC, т.е. кристаллическую решетку типа NaCi и является изоморфным с UN, PuN, LaN, CeN и другими соединениями. ThN может существовать в различных композициях и растворяется в решетке тория в малых количествах, что незначительно повышает точку плавления.
Нитрид тория можно использовать для получения торий-уранового или торий-плутониевого смешанного нитридного сырьевого и делящегося топлива. Th2N3 представляет собой соединение темно-красного цвета, которое можно получить либо непосредственным прокаливанием тория, либо прокаливанием смеси ThO2 с Mg или Ai в среде азота, а также прокаливанием ThC в аммонии. Th2N3 взаимодействует с водой или влажным воздухом с образованием NH3 и ThO2.
Сульфиды. ThS получают прокаливанием металлического тория с требуемым количеством сульфида водорода или восстановлением высших сульфидов гидридом тория. Сульфид тория имеет серебристый металлический блеск и плавится при температуре выше 2200 °С. ThS можно использовать для получения смешанного торий-уранового и торий-плутониевого топлив.
Среди керамических ториевых соединений, рассмотренных выше, только соединения ThO2 и ThC с UO2 и UC соответственно имеют некоторый экспериментальный или эксплуатационный опыт.
- Смешанные оксидные, карбидные и нитридные сырьевые и топливные композиции. Из всего набора сырьевых материалов в виде оксидов, карбидов и нитридов тория, а также топливных материалов на основе UO2, PuO2 и топлива UC, UN, PuC и PuN лишь некоторые комбинации сырьевых и делящихся материалов могут представлять практический интерес. К перспективным соединениям можно отнести следующие: (ThU)O2, (Th, Pu)O2, (Th, U, Pu)O2, (Th, U)C, (Th, Pu)C, (Th, U, Pu)C, (Th, U)N, (Th, Pu)N, (Th, U, Pu)N и т.д. Для иллюстрации и сравнения ниже приведены некоторые предварительные оценки и экспериментальные данные по различным комбинациям смешанного топлива. На рис. 9.11 приведена зависимость коэффициента воспроизводства (или конверсии) и глубины выгорания топлива (Th, U)O2 (с обогащением 235U или 233U) в тяжеловодном корпусном реакторе под давлением PHWR [14] от отношения объемов замедлителя и топлива. На рис. 9.12 — 9.14 приведены плотность смешанного оксидного (Th, Pu)O2 топлива, спеченного в гелии в течение 6 ч при температуре 1650 °С, параметры кристаллической решетки твердого раствора (Th, Pu)O2 и его точка плавления [15]. Плотность (Th, Pu)O2 растет с увеличением содержания PuO2, так как PuO2 тяжелее, чем ThO2. Параметры решетки и точка плавления твердого раствора (Th, Pu)O2, однако, уменьшаются при увеличении содержания PuO2.
Рис. 9.12. Плотность смешанного оксидного топлива ThO2-PuO2, спеченного при Т =1650 вС в течение 6 ч

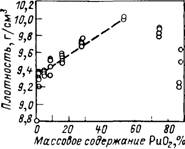
Рис. 9.11. Зависимость глубины выгорания топлива и коэффициента воспроизводства от отношения объемов замедлителя и топлива для оксидного ториевого топлива, обогащенного 233U:

Рис. 9.13. Зависимость параметров решетки твердого раствора (Th, Pu)O2 от содержания PuO2
1 — 1,5% 233U, 150 Вт/см; 2 — 1,5% 233U, 300 Вт/см; 3 — 1,7% 233U, 300 Вт/см; 4- 1,7% 233U, 150 Вт/см
Рис 9.14. Зависимость точки плавления твердого раствора (Th. Pu)O2 от содержания ThO2
Аналогично для смешанных карбидных сырьевых и топливных материалов на рис. 9.15 — 9.18 приведены теплопроводность, термическое расширение, показано влияние температуры на напряжение разрушения и прочность (или твердость) карбидного смешанного топлива (Th, U)C. Для сравнения приведены также данные для соединений (Th, U)C2 и (Th, U)Bet 3. Видно, что теплопроводность и термическое расширение этих соединений растут с увеличением температуры, а напряжение разрушения и прочность уменьшаются.

Рис. 9.17. Влияние температуры на напряжение разрушения сплава U-Th Рис. 9.18. Влияние температуры на твердость сплава Th-U
Ожидается, что ядерные, физические и механические свойства различных комбинаций нитридных и сульфидных сырьевых и топливных материалов аналогичны характеристикам оксидных и карбидных смешанных топлив, приведенных на рис. 9.11 — 9.18.

