Коррозия материалов в четырехокиси азота N2O4 может протекать в основном по двум, заметно отличающимся, механизмам: в результате химической реакции с образованием солей и нитратокомплексных соединений или в результате окисления. Тот или иной механизм взаимодействия определяется главным образом температурой. Заметное влияние может оказать также и давление. Первый механизм имеет место до температуры около 200 °С, второй — при более высокой температуре. В соответствии с этим говорят о низкотемпературной и высокотемпературной коррозии в N2O4 [49].
Низкотемпературная коррозия.
В интервале температуры 20— 200 °С в первой стадии процесса происходит химическое взаимодействие N2O4 и примесей с металлом. Особенно важное значение имеет содержание в теплоносителе HNO3, которое обычно регламентируется.
В результате коррозии образуются малоустойчивые соли и нитрато-комплексы типов (NO+) [Fe2(NO3)4]; (NO+) [Cr (NO3)4]- N2O4(NO+)2 [Ni(NO3)4]-2. Возможно избирательное взаимодействие с составляющими стали, имеющими меньшую термодинамическую устойчивость. Продукты низкотемпературной коррозии в виде солей и нитрато-комплексов обычно слабо связаны с подложкой.
Существуют два температурных интервала для этого типа коррозии. При температуре ниже 100 °С скорость взаимодействия с течением времени уменьшается в результате образования пленок пассивности, которые сначала замедляют, а затем полностью предотвращают химическую реакцию металла с N2O4. Детальное изучение коррозии в первом низкотемпературном интервале проведено в работе [124] резистометрическим методом. Испытывались алюминий и нержавеющие стали. Для алюминия при температуре 25 и 50 °С характерной является относительно высокая скорость коррозии в начальный период, после чего она резко уменьшается и в течение дальнейших испытаний остается постоянной. Для нержавеющих сталей Х18Н10Т и 2Х13Н1МВ1 при 50 °С и содержании в теплоносителе 1 % HNO3 обнаружено возрастание скорости коррозии при опытах длительностью до 30—60 сут с последующим резким снижением седо стационарных значений. Уменьшение скорости коррозии обоих материалов объясняется образованием пленок пассивности. Для нержавеющих сталей формирование их заканчивается лишь через 100—250 сут. Пленки имеют малую толщину (менее 0,5 мкм) и визуально обычно не наблюдаются [48].
В интервале температуры 20—100 °С процессы коррозии идут со сравнительно небольшой скоростью. Практически не повреждаются хромистые и хромоникелевые нержавеющие стали. Для сталей типа Х18Н10Т в течение периода нестационарной коррозии (400—500 ч) изменение размеров образцов не превышает 1 мкм. В области стационарной коррозии характерной скоростью ее являются значения 10-3— 10-5 мм/год. Только при содержании в N2O4 1 % HNO3 стали Х18Н10Т и 2Х13Н1МВ1 корродируют со средней скоростью 2·10-3 мм/год (база соответствующих испытаний составляла 2500 ч [124]). При 100 °С, давлении 2,0 МПа, содержании HNO3 3% для сталей Х18Н10Т, Х18Н12С4ТЮ, X17H13M3T и Х25 характер изменения коррозии во времени тот же. Установившаяся скорость коррозии (0,5—3,0) X10-3 мм/год. Углеродистая сталь, низколегированная сталь 20СГЛ, серый чугун в этих опытах повреждались с высокой скоростью, соответственно равной 0,23; 0,8; 1,4 мм/год. Невысокой стойкостью обладал чистый никель — 0,18 мм/год.
Влияние легирования на коррозионную стойкость сталей изучено в работе [100]. Положительную роль играет хром. Введение в сталь 28% Сr уменьшает скорость коррозии стали примерно в 100 раз. Никель, напротив, оказывает отрицательное влияние: изменение его содержания от 10 до 80% при приблизительно равном содержании хрома ведет к монотонному возрастанию скорости коррозии.
При температуре, большей 100 °С, и давлении 5—20 МПа происходит заметная интенсификация процессов коррозии [72]. Ускорение взаимодействия является следствием как обычного влияния температуры на скорость химической реакции, так и специфических условий, создающихся при взаимодействии сталей с N2O4. Продукты коррозии при повышенных температуре и давлении могут плавиться, разлагаться и препятствовать образованию окисных пленок, т. е. затруднять пассивацию. Образующиеся при этом жидкие слои на поверхности сталей и сплавов могут быть местами скопления азотной кислоты и других примесей, что, в свою очередь, создает условия для протекания электрохимической коррозии. При наличии в замкнутой системе с N2O4 перепада температуры и циркуляции возможен своеобразный перенос массы продуктов коррозии из-за различия их растворимости в теплоносителе при разной температуре. Происходит частичное растворение солей и нитрато-комплексов в горячей части и высаживание их в холодной части в виде кристаллитов размером 5—200 мкм.
Поведение материалов при температуре выше 100 °С изучалось в основном в условиях переходных состояний теплоносителя от жидкости к газу и наоборот, т. е. при кипении и конденсации. Установлено, что в обоих случаях происходит значительное увеличение скорости коррозии.
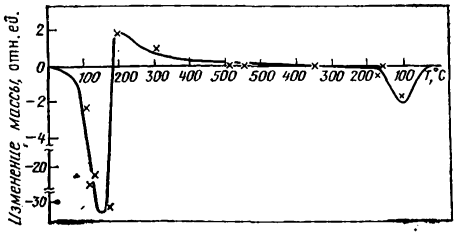
Рис. 5.8. Потеря массы образцов в N2O4 при различной температуре (испытания в контуре с термической конвекцией). В левой части кривой при 100—150 °С — зона кипения, в правой — зона конденсации
Детальное изучение влияния температуры при давлении 5 МПа, включая области кипения и конденсации, на скорость коррозии проведено в работе [125]. Образцы испытывались в петле с термической конвекцией N2O4, состоявшей из автоклавов с температурой 132, 200, 300, 400 °С. В автоклавах с температурой 132 °С имели место либо кипение, либо конденсация теплоносителя, в остальных — образцы находились в контакте с газообразным теплоносителем. Результаты опытов представлены на рис. 5.8 в виде кривой изменения массы образцов из стали 0Х18Н10Т в зависимости от температуры и агрегатного состояния теплоносителя. Содержание HNO в исходной четырехокиси азота составляло 0,66%, длительность испытаний — 3000 ч. При температуре 132 °С и давлении 5 МПа в условиях кипения обнаружено резкое увеличение потери массы образцов. Скорости коррозии, определенные на базе 360 и 3000 ч, мало отличаются друг от друга и составляют 0,3—0,03 г/ (м2•ч). Второй пик потери массы обнаружен в зоне конденсации, но его высота примерно в 10 раз меньше, чем в зоне кипения. Увеличение скорости коррозии при кипении объясняется локальным изменением концентрации HNO3. Экспериментально показано, что у теплопередающей поверхности при кипении концентрация HNO3 может увеличиваться в 5—10 раз при исходном содержании 0,4—0,5%. В области температуры 100—130 °С такое изменение содержания кислоты может на два порядка увеличить скорость коррозии.
Усиление взаимодействия теплоносителя с конструкционными материалами может иметь место не только при непрерывном кипении или конденсации, но и при периодическом смачивании материалов и последующем испарении теплоносителя с их поверхности. Такие процессы характерны для остановок, колебаний температуры или давления в теплопередающих системах.
Эксперименты в подобных условиях проведены в работе (491. Образцы помещались в ноток технической N2O4, имевшей скорость 10— 30 м/с. Температура в петле поддерживалась в пределах 100—130 °С, давление — 2,5—3 МПа. Продолжительность испытаний составляла 360 ч. Изучено большое число нержавеющих хромоникелевых сталей и жаропрочных сплавов в сравнении с хромистой сталью 2X13 и перлитной теплоустойчивой сталью 20ХЗМФ (табл. 5.6). Нержавеющие стали и сплавы, включая хромистые стали, корродируют со скоростью 0,05—0,5 г/(м2-ч). Нестойка в этих условиях перлитная сталь 20Х3МФ (потеря массы до 5 г/ (м2·ч)1 из-за низкого содержания хрома.
Таблица 5.6. Коррозионная стойкость сталей в зонах кипения и конденсации потока технической N2O4

Имеется тенденция к снижению коррозионной стойкости при легировании молибденом и повышению ее при введении в сталь или сплав титана и кремния.
При микроструктурном анализе сталей марок 0Х18Н10Т и Х18Н10Т, использовавшихся в качестве материала ампул и находившихся в контакте с N2O4 при 130 °С, 5 МПа в течение 1000 и 7000 ч, наряду с большой общей коррозией было обнаружено протекание локальной коррозии по границам зерен. В условиях конденсации были проведены эксперименты по изучению влияния легирования на коррозионную стойкость материалов; для ужесточения испытаний четырехокись азота насыщали кислородом. При этом четко проявилось влияние хрома. Так, сталь Х25 оказалась в десятки раз более стойкой, чем сталь Х13. Коррозионная стойкость сталей также увеличивается при легировании их кремнием. Отмечено отрицательное влияние молибдена, добавка которого в количестве 3% приводит к склонности к межкристаллитной коррозии и коррозионному растрескиванию. По той же причине вредным оказалось снижение содержания хрома при одновременном повышении содержания никеля или марганца до 14%>.
Повышение коррозионной стойкости материалов может быть достигнуто не только изменением их состава. Большой эффект дает добавление небольших количеств NO в теплоноситель. Теплоноситель с добавкой NO получил название «нитрин». В этом случае резко уменьшается скорость коррозии сталей во всем низкотемпературном интер вале испытаний, в том числе при кипении и при конденсации. Сталь 0Х18Н10Т в нитрине при температуре 100—150 °С, давлении 916 МПа и длительности испытаний 360 ч корродирует со скоростью 0,0006 г/ (м2•ч). В условиях кипения или конденсации при температуре 100—130 °С, давлении 2,5—3,0 МПа и скорости потока 10—30 м/с скорость коррозии ее не превышает 0,001—0,004 г/ (м2·ч). Малая скорость коррозии стали Х18Н10Т в кипящем нитрине была получена также при испытаниях трубок с тепловым потоком через стенку до 58 кВт/м2 [123]. Ингибирующее действие окиси азота NO объясняется смещением реакции 3N2O4+2Н2O↔HNO3+2NO в сторону образования N2O4 и уменьшением вследствие этого количества азотной кислоты.
При испытании в нитрине, в том числе при кипении и конденсации, не замечено существенного различия в поведении сталей разного состава. Коррозионная стойкость нержавеющих хромистых и хромоникелевых сталей, жаропрочных сталей и сплавов на никелевой основе практически одинакова и близка к таковой для стали 0Х18Н10Т (табл. 5.7) [77]. Практически такую же высокую коррозионную стойкость имеет перлитная сталь 20Х3МВФ. Это открывает перспективу для применения более дешевых низколегированных сталей.

