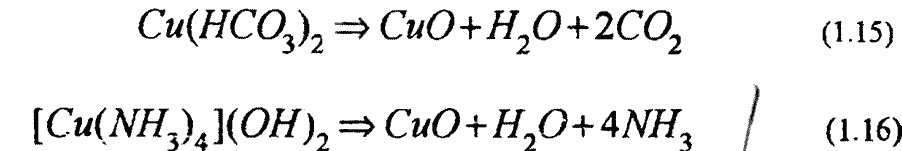Требования к качеству применяемых в энергетике сталей по основным показателям, таким, как жаростойкость, коррозионная стойкость и жаропрочность, определены достаточно четко.
Так, для изготовления трубных систем котлов и паропроводов энергоблоков 500 и 800 МВт применяются материалы, представленные в табл. 1.3 [10].
Состав металла по-разному влияет на развитие различных видов коррозии. Из-за отсутствия данных по многим из металлов невозможно привести сравнительные характеристики интенсивности протекания процессов коррозии в периоды работы и простоя оборудования. Достаточно надежные сведения имеются лишь по кислородной коррозии котельных сталей в эксплуатационных, стояночных и пусковых режимах работы оборудования. В табл. 1.4 представлено сопоставление коррозионной стойкости сталей 12Х1МФ, 1X13 иХ18Н10Т при различных температурах [1]. Здесь СК - скорость коррозии стали 12X1МФ при соответствующей температуре.
Как же влияют входящие в состав сталей элементы на их свойства? Многочисленными исследователями установлено, что углерод оказывает значительное отрицательное влияние на жаропрочность хромистых сталей, выгорая из поверхностного слоя металла при сварке.
Хром и никель являются основными легирующими компонентами, способствующими пассивации железа.
Перлитные малоуглеродистые стали типа 15ХМФ обладают малой коррозионной стойкостью при высоких температурах поэтому, например, железооксидные отложения на поверхностях нагрева нижней радиационной части (НРЧ) почти на 50 % состоят из окалины.
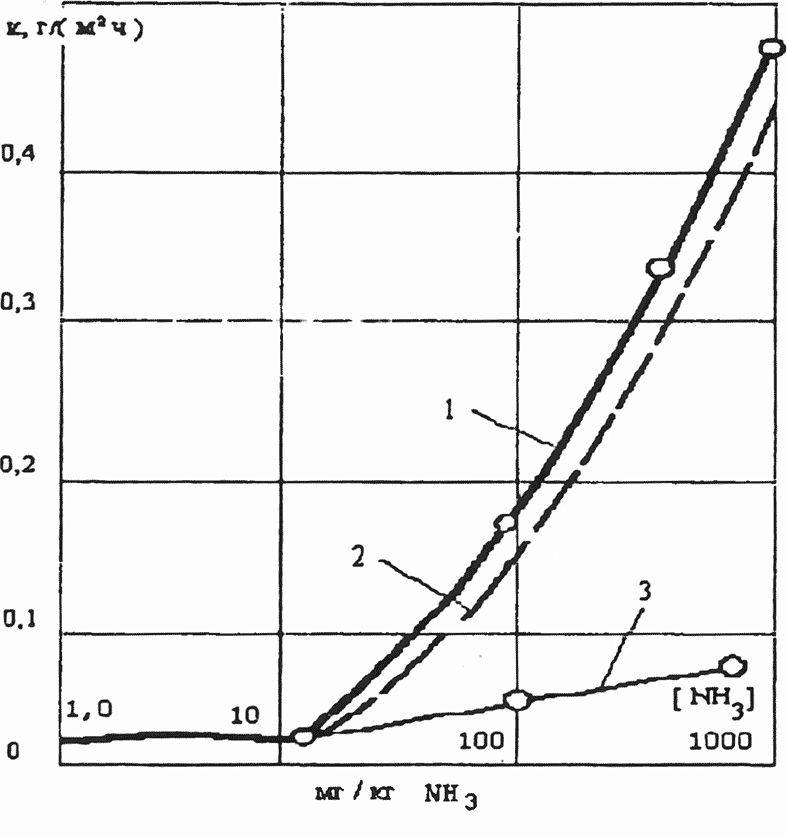
Рис. 1.8. Зависимость скорости коррозии латуни ЛО-70-1 от концентрации аммиака при скорости движения конденсата 1 м/с:
1-3 содержание ΝH3 соответственно 1-1,5; 0,4 к 0,09 мг/кг
Таблица 1.3 Материалы трубных систем котлов и паропроводов энергоблоков 500 и 800 МВт (выборочные данные)
Узел | Марка стали | Параметры | Особые условия | Предъявляемые требования | |
Температура, С | Давление, МПа | ||||
Поверхности нагрева котла | 20 12ХМФ 12Х2МФСР 12Х18Н12Т ЭП184 | 230-450 400-565 590 610 610 | 32,0 25,0-30,0 25,0-30,0 25,0-30,0 25,0-30,0 | Коррозионные условия, циклические нагрузки | Коррозионная стойкость, жаростойкость, циклическая прочность |
Коллекторы свежего пара | 15ΧΙΜ1Φ 12X1МФ | 545 | 25,5 | Циклические нагрузки | Жаростойкость, жаропрочность, циклическая прочность |
Корпуса арматуры | 15Х1М1Ф | 545 | 24,0 | То же | Жаропрочность, циклическая прочность |
Таблица 1.4 Скорость кислородной коррозии сталей при различных температурах в обессоленном конденсате (Содержание кислорода 0,1 мг/кг)
Марка стали | Температура среды. °C | ||
60 | 90 | 360 | |
12X1МФ | СК1 | СК2 | СК3 |
1X13 | 0,05 СК1 | 0,07 СК2 | 0,1 СК3 |
Х18Н10Т | 0,02 СК1 | 0,04 СК2 | 0,05 СК3 |
Высоколегированные стали при высоких давлении и температурах подвержены коррозии при повышенной концентрации щелочи, при этом гидраты оксидов железа переносятся с поверхности в толщу раствора. При содержании никеля в аустенитных сталях 8-10 и хрома 18% сталь склонна к коррозионному растрескиванию; с увеличением содержания никеля до 45-47% сталь становится устойчивой по отношению к межкристаллитной коррозии. Данные по влиянию хрома на коррозионное растрескивание аустенитных сталей различны. Стойкость нержавеющих сталей к коррозионному растрескиванию увеличивается при добавлении в нее молибдена, вольфрама, титана и ниобия, а также азота даже при его незначительных концентрациях (около 0,01-0,035%). При добавлении в сталь бериллия, кремния, кобальта, цинка, кадмия стойкость ее также повышается.
Одной из причин коррозии сталей является ее наводороживание, выражающееся в том, что при высоком давлении и температуре водород в атомарном виде реагирует с углеродом, находящимся в металле:
![]() (1.12)
(1.12)
или в карбидах:
![]() (1.13)
(1.13)
При этом сталь обезуглероживается, а образующийся метан СH4 располагается в основном по границам зерен. Аустенитные стали наводороживаются лишь в небольшой степени и практически не подвержены водородной хрупкости.
Перлитные стали, содержащие легирующие добавки (Cr, Ni, Мо и др.), по сравнению с обычными сталями более устойчивы к равномерной пароводяной коррозии. Ферритные, аустенитно-ферритные и аустенитные стали устойчивы против кислородной, углекислотной, пароводяной и подшламовой коррозии, однако подвержены коррозионному растрескиванию в щелочной среде.
По механизму протекания коррозионного процесса различают химическую и электрохимическую коррозию металла. Химическая коррозия подчиняется только законам химической кинетики гетерогенных реакций. К этому виду можно отнести коррозию в среде сухих газов, в перегретом паре при температурах свыше 570X3. Электрохимическая коррозия, например коррозия металлов в электролизе, подчиняется законам электрохимической кинетики.
По условиям протекания различают следующие виды коррозии:
- газовая коррозия, протекающая при полном отсутствии влаги на поверхности металла при высоких температурах;
- коррозия в неэлектролитах, например коррозия металла в продуктах неполного сгорания сернистых нефтей при повышенных температурах;
- кислотная, щелочная, солевая и другие виды коррозии в электролитах;
- почвенная, грунтовая или подземная коррозия, этим видам коррозии подвержены, например, уложенные в землю трубопроводы;
- атмосферная коррозия;
- коррозия под действием электрического тока, примером может служить коррозия заложенных в почву труб блуждающим током;
- контактная коррозия, вызванная контактом с металлом, имеющим более положительный химический потенциал, чем потенциал основного металла;
- коррозия под напряжением, определяющаяся одновременным воздействием на металл коррозионной среды и механических напряжений;
- коррозия, связанная с ударным или истирающим воздействием внешней среды;
- подземная биологическая коррозия под влиянием продуктов жизнедеятельности микроорганизмов.
Как газовая коррозия, так и коррозия в неэлектролитах относятся к химической коррозии металла.
В зависимости от формы коррозионные повреждений коррозия подразделяется на общую и местную. Различают местную коррозию пятнами, когда корродируют отдельные относительно большие области поверхности металла на небольшую глубину, и язвенную коррозию, при которой металл поражается на ограниченных участках на большую глубину. Ракушечная коррозия металла развивается под слоем отложений и является разновидностью язвенной коррозии, протекающей с образованием язв большого диаметра. При точечной коррозии поражения локализуются в отдельных точках. Этот вид коррозии вызывается, как правило, действием кислорода при простое оборудования.
Подповерхностная коррозия начинает развиваться на поверхности металла, но затем распространяется под ней. Примером может служить коррозия недоброкачественного листового металла.
При коррозионном растрескивании, развивающемся при наличии растягивающих усилий, коррозионная трещина может как распространяться по границам зерен, так и перерезать тело кристаллита. Продукты коррозии остаются внутри металла, ухудшая его механические свойства, этому виду коррозии особенно подвержены аустенитные стали и латуни.
При избирательной коррозии из сплава в раствор переходит преимущественно один из компонентов. Характерным для этого вида коррозии можно считать обесцинкование латуней.
Некоторые типы коррозионных разрушений представлены на рис. 1.9 и 1.10.
В зависимости от коррозионного агента различают кислородную (стояночную или эксплуатационную) коррозию, которую рассматривали выше, а также нитритную, пароводяную, водородную, щелочную, углекислотную, аммиачную и др.
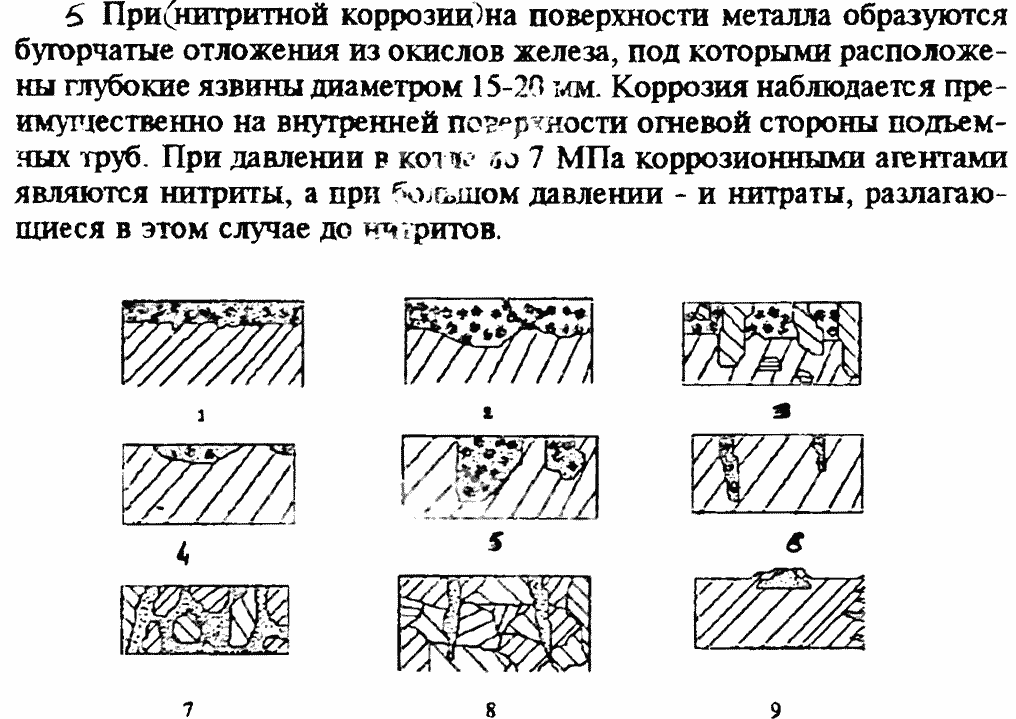
Рис. 1.9. Типы коррозионных разрушений:
1,2 - сплошная коррозия; 4-9 - местная коррозия; 1 - равномерная коррозия; 2 - неравномерная; 3 - структурно-избирательная; 4 - коррозия язвами; 6 - точечная; 7 - межкристаллитная; 8 - транскристалитная; 9 - подповерхностная.
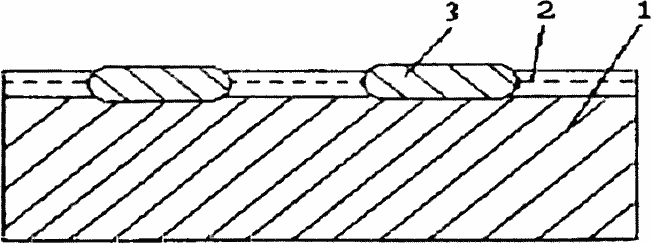
Рис. 1.10. Подшламовая коррозия:
1 - железо; 2 - Fe2O3·тН2O; 3 - Fe2O4
Пароводяная коррозия имеет равномерный характер и возникает под действием высокотемпературного пара. Одной из причин пароводяной коррозии являются внутренние отложения на поверхностях нагрева или тепловые перекосы в топке, которые приводят к увеличению температуры.
В эксплуатации наблюдается случаи, когда котел, работающий на твердом топливе, в силу необходимости временно переводят (на смену, сутки) на мазут и одновременно снижают производительность котла. Скорости движения среды в трубах снижаются, пузырьковое кипение переходит в пленочное, и температура стенки металла труб возрастает на 100-200°С выше эксплуатационной. При смыве паровой пленки водой металл резко охлаждается, защитная окисная пленка разрушается, и процесс коррозии идет беспрепятственно. Коррозионные разрушения могут иметь вид цепочки больших язвин на огневой стороне экранных труб или бороздок шириной 10-50 мм с углублениями диаметром более 10 мм. В таких случаях образования свища и разрыв трубы могут наступить через несколько десятков часов [1].
Пароводяная коррозия часто сопровождается наводороживанием металла и последующим разрушением экранных труб под действием водорода, образующегося в результате реакции:
![]() (1.14).
(1.14).
На основании экспериментального материала и по эксплуатационным данным можно предположить, что режим кипения является решающим при протекании водородной коррозии. По мнению зарубежных специалистов, водородные повреждения металла являются также следствием первичных коррозионных процессов, развивающихся на начальной стадии эксплуатации котельного оборудования, при этом выделяется водород. В местах этих повреждений образуется твердый слой хрупких окислов, препятствующих диффузии водорода в воду.
Истинное содержание водорода в металле практически невозможно определить, так как он выделяется из металла в период его остывания. Процесс наводороживания стали фиксируют по обезуглероживанию образцов и по растрескиванию и разбуханию стали, проявляющемуся при металлографическом исследовании.
При наличии в конденсате углекислоты происходит существенное снижение pH. Так, при 25 С и содержании СO2= 0,045 мг/кт значение pH снижается до 6,31, а при 0,48 мг/кг СO2 - до 5,7. В слабокислой среде в отсутствие кислорода процессы коррозии протекают с водородной деполяризацией, а с вводом кислорода - дополнительно еще и с кислородной деполяризацией [41]:.
Как уже указывалось выше, угольная кислота в воде диссоциирует на ионы не полностью и в значительной степени находиться в виде недиссоциированных молекул. Разрядившиеся в процессе коррозии ионы водорода появляются вновь за счет дальнейшей диссоциации.
При этом pH среды изменяется мало, а процесс коррозии продолжается с прежней интенсивностью.
Особенно опасна углекислотная коррозия для медных сплавов, когда уже следы СО, в конденсате могут выщелачивать медь с получением бикарбоната меди Си(НСO3)г, а в присутствии аммиака - с получением комплексного соединения![]()
Эти соединения неустойчивы и разлагаются