Березина Т. Г.
Коррозия металла деталей теплоэнергетического оборудования
учебное пособие
Челябинск Издательство ЧФ ПЭИПК 2000
Петербургский энергетический институт повышения квалификации руководящих работников и специалистов Челябинский филиал

Рассмотрены основные виды коррозии теплоэнергетического оборудования тепловых электростанций. Описаны механизмы, причины и феноменологические особенности коррозии перлитных марок сталей. Приведены примеры эксплуатационных разрушений.
Учебное пособие предназначено для специалистов служб, лабораторий металлов и сварки и центров диагностики, занимающихся вопросами надёжности эксплуатации металла энергооборудования и оценкой их остаточного ресурса.
Введение
В отечественной теплоэнергетике в настоящее время сложились определённые условия эксплуатации оборудования, которые кратко можно охарактеризовать следующим образом:
- значительная часть тепломеханического оборудования выработала свой нормативный ресурс.
- массовая замена изношенного оборудования в ближайшие годы из- за экономической ситуации в стране маловероятна.
- 20-30% установленной мощности выводится в резерв, при этом не всегда обеспечивается необходимая консервация оборудования.
- Возросла доля оборудования, работающего в маневренном режиме.
Такие условия эксплуатации приводят к тому, что в значительной степени фактический ресурс деталей энергоустановок зависит от развития коррозионных процессов. Диагностика причин коррозионных повреждений металла позволяет ориентироваться в возможных нарушениях эксплуатации оборудования и водно-химического режима, разрабатывать мероприятия по устранению причин коррозионных повреждений, создавать необходимую систему контроля в целях своевременного выявления повреждений и оценивать остаточный ресурс оборудования с учётом протекающих коррозионных процессов
В настоящем пособии рассмотрены основные виды коррозионных повреждений металла энергетического оборудования, основные механизмы этих процессов и феноменологические особенности их проявления.
Рассмотрено влияние такого продукта коррозии, как водород, на свойства сталей.
Пособие описывает особенности и механизмы разных видов коррозии перлитных марок сталей. Виды коррозии высокохромистых и хромоникелевых аустенитных сталей подробно описаны в литературе и в данном пособии не рассматриваются.
Глава 1. Коррозия металла. Общие положения.
Коррозия — это разрушение металла в результате химической или электрохимической реакции. В некоторых случаях химическое воздействие сопровождается эрозионными процессами и называется коррозионным износом. Коррозионные процессы по большей части являются электрохимическими. К электрохимической коррозии относятся процессы разрушения металлов в электролитах, в том числе во влажных атмосферах и газах. Электрод, на котором происходит реакция восстановления, те. электроны из металла переходят в раствор, называется катодом. Электрод, на котором происходит окисление (электроны поступают из раствора в электрод) называется анодом Пример анодной реакции: Fe -> Fe 2 + 2е. Ионы металла переходят в раствор. Эта реакция протекает быстро в кислых средах и замедленно в нейтральных и щелочных средах. Таким образом повреждение металла в условиях коррозии протекает на аноде. Вместе с тем скорость коррозии определяется скоростью катодных процессов, часто при участии ионов водорода.
Обязательным условием протекания электрохимической коррозии является наличие микрогальванического элемента, состоящего из катодного и анодного участков. Можно выделить три причины образования этих участков:
- химическая или структурная неоднородность металла. Любые поверхности металла с вкраплением примесей представляют собой совокупность элементов, замкнутых между собой через основной металл. При отсутствии в металле защитных плёнок при погружении в электролит создается большое количество анодных и катодных участков макро и микронар, которые создают условия для протекания коррозионного процесса. В перлитных сталях анодным участком являются зёрна феррита, катодным - загрязнения и включения в структуре металла. Микропарой может быть тело зерна и его граница (см. схему рис. 1.1). К структурной неоднородности относится и наличие локальных механических напряжений, сопровождающихся деформационными процессами, например, при развитии процессов малоцикловой усталости. Участки наклепанного металла являются анодом, катодом служит ненапряженный основной металл.
- концентрационная неоднородность коррозионной среды. Такая неоднородность возникает в местах образования застойных зон, например, в трещинах, питтингах, щелях, под слоем солевых отложений,
- неоднородность физических условий на границе раздела металл-среда (перепад температур, изменение скорости движения электролита).
Возникновение на поверхности металла коррозионных элементов является обязательным условием коррозионного процесса. Создание плотного защитного окисного слоя, который всегда образуется в условиях работы при повышенных температурах, предотвращает развитие процессов коррозии. Коррозия протекает там, где имеются нарушения плотности окисного слоя.
В процессе развития коррозии происходит снижение потенциала электродов. Это явление называется поляризацией, которая тормозит работу коррозионного элемента. Вещества, приводящие к деполяризации, ускоряют коррозию. Так, кислород играет роль деполяризатора. В нейтральных и щелочных средах котельной воды кислород усиливает процессы разрушения. Кроме кислорода деполяризация осуществляется под влиянием ионов водорода, нерастворимых в воде окислов железа и меди, нейтральных молекул солей-окислителей.
Влияние различных факторов на развитие коррозионных процессов.
Влияние кислорода.
При комнатной температуре в воде с нейтральной, а также со слабощелочной или слабокислой реакцией заметная коррозия железа наблюдается только в присутствии кислорода. Зависимость скорости коррозии от концентрации кислорода носит линейный характер. При больших концентрациях кислорода наступает пассивация железа за счёт образования окисной плёнки и скорость коррозии снижается (рис. 1.2а). При разрушении окисной плёнки появляются места локального нарушения пассивации, что вызывает образование питтингов. В случае, если в растворе наряду с кислородом содержится значительное количество хлоридов, например, в морской воде, железо вообще не пассивируется. В такой среде любое возрастание концентрации кислорода увеличивает скорость коррозии (рис. 1.2б).
Влияние температуры.
Если процесс коррозии в воде контролируется диффузией кислорода, то для данной концентрации кислорода скорость коррозии удваивается при повышении температуры на каждые 30°С. Если коррозия сопровождается выделением водорода, то скорость её возрастает более, чем вдвое с увеличением температуры на 30°. При высоком давлении повышение температуры также приводит к заметному усилению коррозии даже в щелочной среде. Это связано с возрастанием скорости диффузии кислорода к катодным участкам и с ослаблением защитных свойств окисных плёнок.
Активность водородных ионов определяет скорость коррозии. Их активность в электролите характеризуется водородным показателем РН.
РН = - 1g а - активность ионов водорода.
При РН = 7 среда нейтральная
РН < 7 кислая среда
PH > 7 щелочная среда
Влияние РН аэрированной чистой воды на коррозию железа при комнатной температуре показано на рисунке 1.3.
В пределах РН = 4-10 скорость коррозии определяется только скоростью диффузии кислорода, оксидная плёнка обновляется в ходе процесса, скорость коррозии постоянна.
При РН < 4 плёнка окиси железа растворяется. Увеличение скорости коррозии является результатом значительной скорости выделения водорода.
При РН > 10 железо всё больше и больше пассивируется, скорость коррозии падает
Влияние состава среды.
Прибавление к конденсату, содержащему кислород, хлоридов стимулирует развитие коррозии. Хлориды являются анодными стимуляторами коррозии, т. к. они разрушают защитную плёнку на анодных участках.
Механизм разрушения окисной плёнки под действием хлоридов заключается в следующем. Хлор-ионы хорошо адсорбируются окисной плёнкой, вытесняют и замещают находящиеся в ней ионы кислорода. После такой замены в точках адсорбции хлор-ионов получается растворимое соединение - хлористое железо - с образованием пор на этих участках. Прибавление едкого натра ослабляет общую коррозию.
Наличие шлама и накипи на поверхностях нагрева котла является замедлителем коррозионных процессов. NaOH и Na3РО4 присутствующие в котловой воде, способствуют прочному сцеплению шлама с поверхностью нагрева.
Скорость кислородной коррозии имеет прямую зависимость от скорости циркуляции котловой воды. С возрастанием скорости циркуляции увеличивается приток кислорода к поверхности металла и ускоряется кислородная коррозия. При вялой циркуляции скорость кислородной коррозии резко снижается.
Важным фактором развития коррозии является образование кипящего слоя в теплонапряжённых участках. В этих зонах происходит разрушение защитной плёнки механическим воздействием пузырьков пара. Происходит сочетание механического и химического воздействия. В этих условиях коррозия может идти с высокими скоростями. Такая коррозия в большей степени характерна для котлов с пониженными параметрами пара. При высоком и особенно закритическом давлении кавитационное воздействие пара незначительно.
Влияние легирования и металлургических факторов на коррозионную стойкость стали.
Коррозионная стойкость обычной углеродистой стали слабо зависит от её состава. В кислых средах повышение содержания углерода заметно снижает коррозионную стойкость. Для обеспечения необходимой коррозионной стойкости в металл вводят легирующие добавки
Хром повышает коррозионную стойкость. При содержании хрома в стали свыше 12% сталь становится нержавеющей. Повышает коррозионную стойкость медь. При больших содержаниях (свыше 14%) повышает коррозионную стойкость кремний. Никель в небольших количествах не изменяет коррозионной стойкости стали, с увеличением содержания никеля возрастает стойкость стали к действию кислот.
Резко снижает коррозионную стойкость наличие в стали серы.
Коррозионная стойкость стали зависит от режима их термической обработки. Закалённая на мартенсит углеродистая сталь обладает высокой стойкостью к коррозии. После низкого и среднего отпуска с распадом мартенсита скорость коррозии резко возрастает. В высокоотпущенной стали скорость коррозии невелика (рис. 1.4 ).
Влияние способа выплавки стали обычно проявляется в кислых и сильнощелочных средах. Чистое железо коррозирует в кислотах гораздо медленнее, чем железо или сталь с большим содержанием углерода и азота.
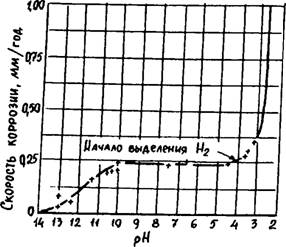
Рис. 1.3 Влияние РН на коррозию железа в аэрированной мягкой воде
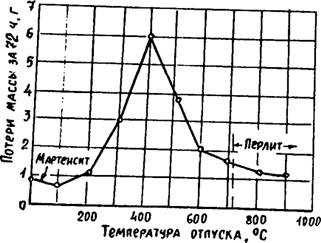
Рис 1.4. Влияние термической обработки на коррозию углеродистом стали в 1% H2SO4
Например, бессемеровская сталь имеет высокое содержание азота, что делает её более чувствительной к коррозионному растрескиванию под напряжением в щелочных и нитратных растворах по сравнению с мартеновской сталью. Поэтому для изготовления паровых котлов обычно применяют мартеновскую сталь

