Механизм окисления ископаемых углей молекулярным кислородом представляет собой сложный многостадийный процесс, описываемый теорией уголь-кислородных промежуточных соединений. Эта теория предполагает, что в самовозгорающихся углях существуют вещества, способные окисляться молекулярным кислородом при низких температурах. В первой стадии молекулярный кислород физически адсорбируется поверхностью окисляемого вещества, удерживается на ней за счет адсорбционных сил сцепления и постепенно внедряется в структуру молекулы, образуя с ее атомами сначала непрочные промежуточные уголь-кислородные соединения, постепенно переходящие в стабильные продукты окисления.
В основу современных представлений о механизме окисления угля положена та же теория уголь-кислородных комплексов, но, кроме того, использованы учение о радикально-цепном механизме реакции аутоокислению [30] и перекисная теория аутоокисления, которую разработали независимо друг от друга А. Н. Бах [31] и К. Энглер.
В перекисной теории аутоокисления Баха-Энглера все вещества рассматриваются как соединения, имеющие в своем составе ненасыщенные связи. При приближении к молекуле такого вещества молекулы кислорода в последней происходит разрыв одной из валентных связей и образуется радикал — О — О —, который цели ком вклинивается в молекулу окисляемого вещества. В результате внедрения образуется промежуточное соединение, обладающее свойствами перекиси. При окислении предельных углеводородов, циклопарафинов, алкилароматических углеводородов и многих других органических соединений образуются продукты, в которых строение органического радикала сохраняется, как и у исходного углеводорода, а внедрение перекисной группы происходит по месту разрыва одной из углерод-водородной связи:
![]() (4.2)
(4.2)
Характерной особенностью всех органических перекисных соединений является склонность их к самопроизвольному распаду, в результате которого образуются осколки молекулы с ярко выраженными ненасыщенными свойствами:
![]() (4.3)
(4.3)
Эти осколки называют свободными радикалами. Они обычно недолговечны, чрезвычайно активны и могут вступать во взаимодействие даже с малоактивными веществами.
Суммируя уравнения (4.2) и (4.3), получаем уравнение, из которого видно, что в результате взаимодействия одной молекулы кислорода с органическим веществом образуются два свободных радикала. Один из этих радикалов R обладает неспаренным электроном у углеродного атома и может легко реагировать с молекулой кислорода, образуя новый радикал перекисного типа,
но теперь уже с неспаренным электроном у атома кислорода:
![]()
(4.4)
Этот радикал вступает во взаимодействие с нейтральной органической молекулой, образуя уже три новых свободных радикала:
![]()
(4.5)
которые вновь реагируют с молекулой кислорода по уравнению (4.4) и затем по уравнению (4.5), непрерывно увеличивая число свободных радикалов в реакционной смеси.
Второй свободный радикал, образовавшийся по уравнению (4.3), —НОО — с неспаренным электроном у кислорода, реагирует с нейтральной молекулой органического вещества, образуя радикал R и перекись водорода Н2О2:
![]() (4.6)
(4.6)
Свободный радикал R далее реагирует по уравнениям (4.4) и (4.5), а перекись водорода, реагируя еще с одной молекулой органического вещества, образует стабильные продукты окисления:
![]()
Таким образом, чередование взаимодействия свободных радикалов то с молекулярным кислородом, то с нейтральными молекулами органического вещества ведет к размножению активных центров в реакционной смеси и самопроизвольному (ауто) ускорению процесса окисления. Реакции, в которых каждый элементарный акт ведет к увеличению количества активных центров, называют разветвленными цепными реакциями, а свободный радикал R, являющийся как бы «переносчиком» или активатором молекулярного кислорода, — ведущим радикалом.
Реакции, в которых разветвление цепи сопровождается появлением новых радикалов, по природе отличных от ведущего, называют реакциями с вырожденным разветвлением. В настоящее время считают, что аутоокисление большинства сложных органических веществ имеет радикально-цепной механизм с вырожденным разветвлением, т. е. механизм, при котором в сферу реакции могут вовлекаться вещества, не способные непосредственно окисляться молекулярным кислородом.
Ускорителями (проматорами) процессов окисления органических веществ являются ионы металлов переменной валентности, и в частности соединения железа.
Механизм окисления бурого и каменного углей.
При окислении углей в очень мягких условиях, в частности при штабельном хранении, соотношение между концентрациями сорбированного из межкускового пространства кислорода и выделившейся двуокиси углерода выражается для случая бурых углей уравнением (4.1), а для зрелых углей и антрацитов равенством:
![]()
Анализ этих закономерностей дает основание предполагать, что большой выход двуокиси углерода, характерный для бурых и молодых каменных углей, объясняется окислением преимущественно метильных групп, непосредственно присоединенных к ароматическому ядру. В зрелых каменных углях и антрацитах окисляются полиметиленовые структуры.
На основании изложенного окисление бурых и молодых каменных углей может быть представлено приведенной ниже схемой. Первая стадия, когда происходит зарождение и накопление свободных радикалов, ведущих кинетические цепи, описывается уравнениями;

или в общем виде
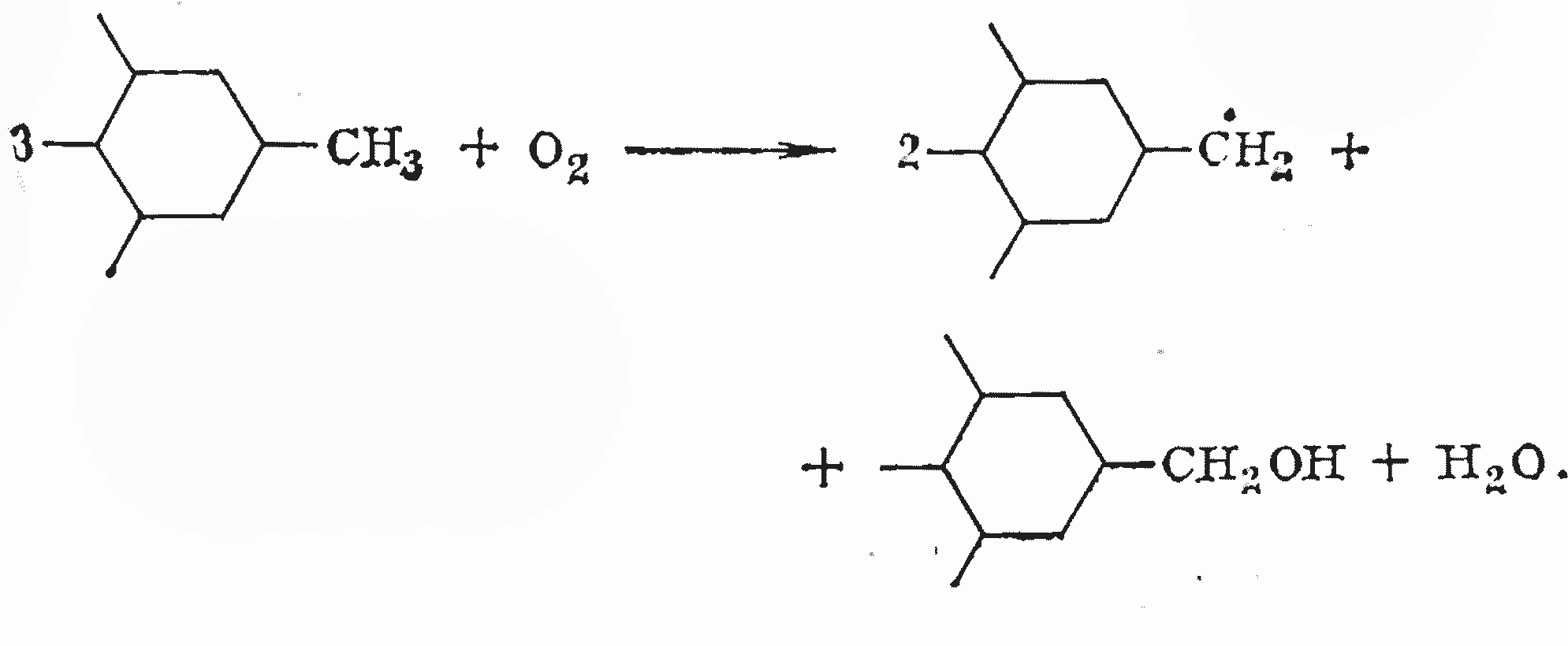
Основная стадия окисления начинается со взаимодействия ведущего радикала с неспаренным электроном у углеродного атома метильной группы с молекулярным кислородом и завершается взаимодействием ведущего радикала с неспаренным электроном у кислородного атома с неокисленной молекулой углеводорода:
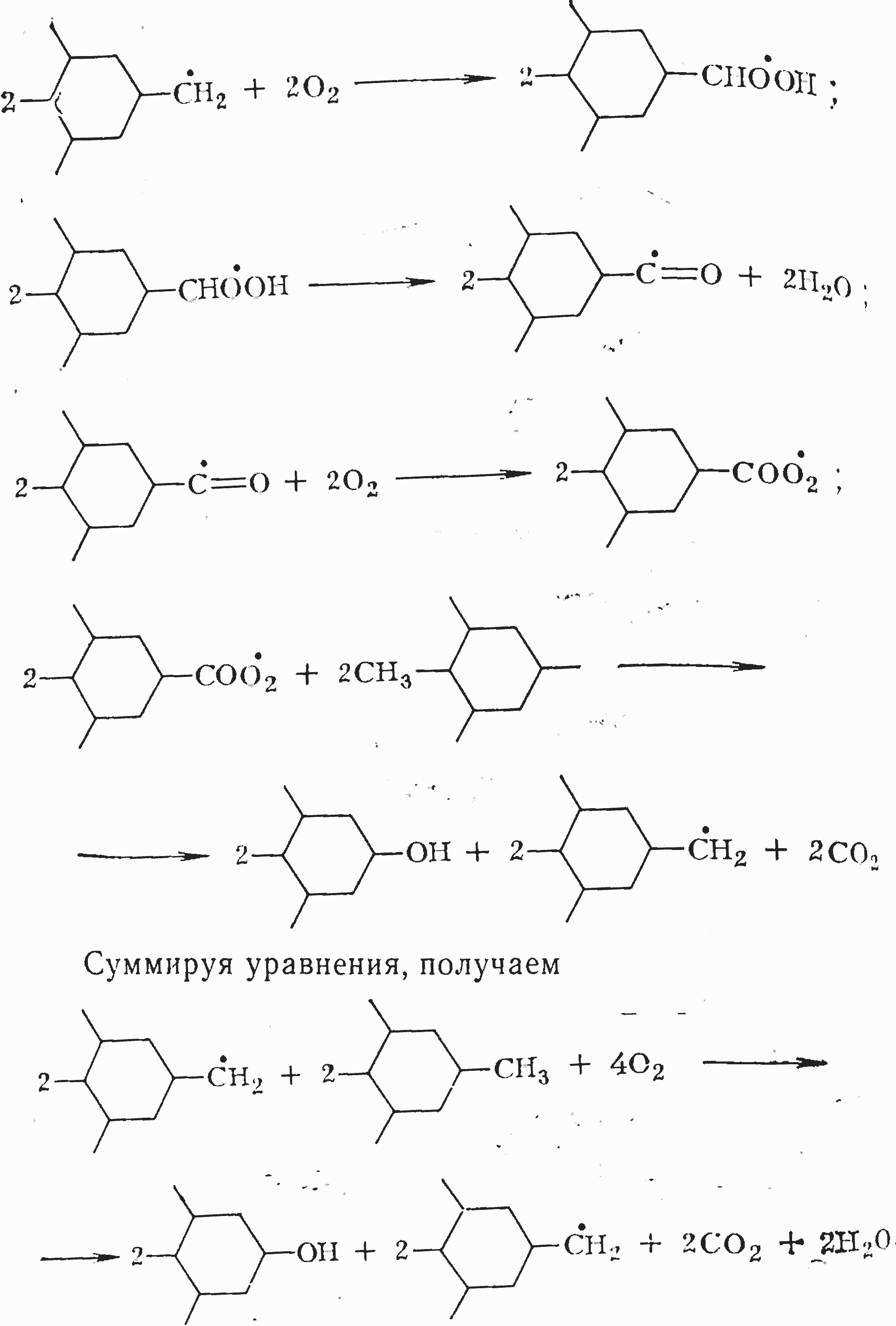
Из последнего уравнения видно, что в результате завершения цикла в реакционной среде вновь появляются те же два ведущих радикала, которыми начинался цикл. Для этого периода характерно, что из четырех молекул кислорода образуются две молекулы двуокиси углерода, т. e. то же соотношение, которое фиксируется при окислении бурых углей как в лабораторных условиях, так и при штабельном хранении. Происходящая при этом замена метильных групп на гидроксилы обусловливает некоторое увеличение массы окисляемого материала.
Механизм окисления зрелых каменных углей и антрацитов можно представить как окисление углеродных атомов, одновременно являющихся третичными атомами полиметиленовой структуры, и атомами, находящимися в α-положеиии по отношению к ароматическому ядру. При достаточной глубине окисления по этим атомам происходит разрыв углерод-углеродной цепи и расщепление молекулы на высокомолекулярный остаток и более или менее крупные осколки периферийных структур, которые, рассеиваясь в окружающей среде, составляют потерю массы окисляемого материала.
Механизм окисления торфа.
До недавнего времени большинство исследователей, изучающих причины и механизм самонагревания и самовозгорания торфа, придерживались биологической концепции, согласно которой принималось, что начальная стадия самонагревания торфа обусловлена жизнедеятельностью микроорганизмов. В последние годы стало известно большое количество фактов, противоречащих этой концепции и утверждающих представление о процессах самонагревания и самовозгорания как следствие обычного аутоокисления молекулярным кислородом окружающей атмосферы.
Исследование состава газа в торфяных штабелях показало, что повышенная концентрация двуокиси углерода в межкусковом пространстве имеет тенденцию к снижению по мере установления равновесного состояния, но концентрация всегда остается выше, чем в штабелях бурого угля. Что же касается соотношения концентраций кислорода, сорбированного из межкускового пространства, и образовавшейся двуокиси углерода, то оно более точно выражается формулой
![]()
где А — поправка, значение которой составляет несколько процентов.
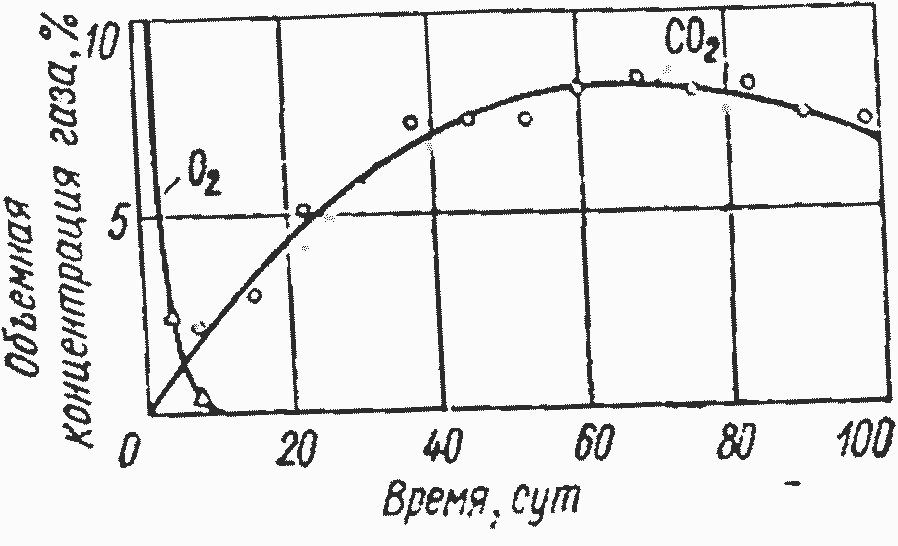
Рис. 4.7. Изменение во времени состава газа межкускового пространства в адсорбционной колонне, загруженной бурым углем.
Оба приведенных факта свидетельствуют о наличии в торфяных штабелях источников образования двуокиси углерода СО2 иной природы, чем ассимиляция молекулярного кислорода межкускового пространства или атмосферы.
При температурах около 20—30°С, когда скорость небиологического окисления мала, а для деятельности микроорганизмов созданы благоприятные условия, возможно, что биологический фактор кратковременно становится доминирующим. С повышением температуры материала до 60°С и более происходит подавление жизнедеятельности микроорганизмов и окисление принимает форму типичного аутоокисления.
На рис. 4.7 показаны кривая скорости поглощения кислорода и кривая нарастания содержания двуокиси углерода в межкусковом пространстве адсорбционной колонны. Видно, что молекулярный кислород из межкускового пространства полностью поглощается углем в течение 10—12 сут, тогда как концентрация двуокиси углерода постепенно нарастает в течение 60—70 сут. Таким образом, для образования конечных продуктов окисления из сорбированного углем кислорода при низкотемпературном окислении необходимы недели и месяцы.
Продолжительность цикла аутоокисления.
Процесс окисления угля был воспроизведен на адсорбционной колонне диаметром 150 мм и эффективной высотой загрузки угля около 2 м. Колонна загружалась челябинским бурым углем Б3 с размером зерен от 0,5 до 3,0 мм.
Различие в скорости поглощения кислорода из газовой фазы и скорости окисления угля обусловлено адсорбционной насыщенностью угля по отношению к молекулярному кислороду. Если уголь ненасыщен, то он быстро адсорбирует кислород, но это вовсе не значит, что так же легко и быстро происходит его окисление. Тем не менее принято скорость окисления угля измерять скоростью адсорбции им кислорода [32, 33]. Очевидно, скорость окисления угля и скорость адсорбции им кислорода могут приниматься как равноценные величины только в том случае, если скорость адсорбции измеряется при полной адсорбционной насыщенности угля кислородом и при установившемся равновесии во всех стадиях окисления. При адсорбционной ненасыщенности угля кислородом, неустановившемся равновесии и переменных температурах скорость адсорбции кислорода неверно отражает кинетические свойства угля и скорость его окисления.
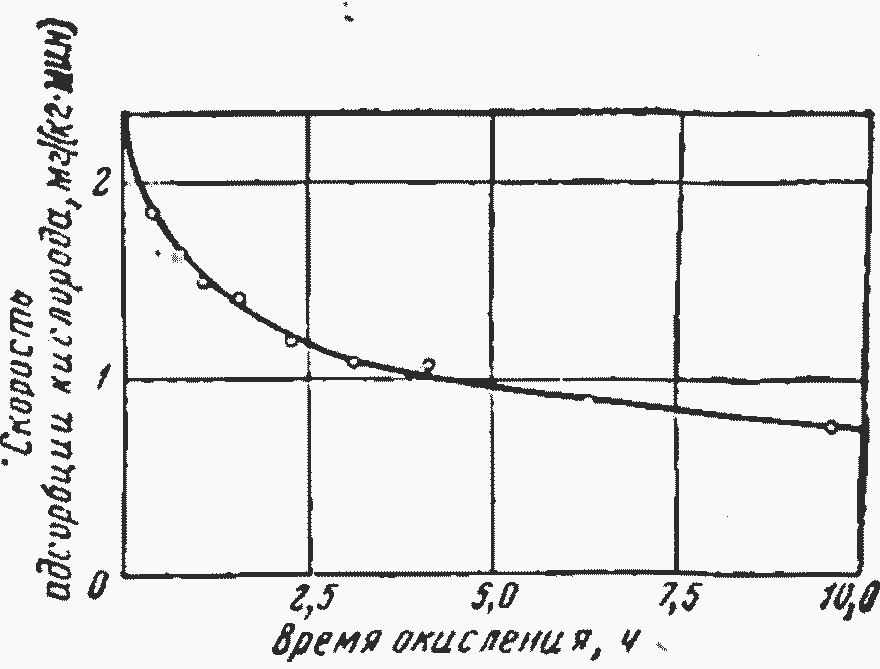
Рис. 4.8. Зависимость от времени скорости сорбции кислорода каменным углем.
Одна из особенностей аутоокисления природных углей заключается в том, что скорость их окисления в изотермических условиях непрерывно уменьшается. На рис. 14.8 показано уменьшение скорости и адсорбции кислорода каменным углем при 100°С. Аналогичные зависимости отмечаются и по другим показателям, например удельной теплоте сгорания и выделению двуокиси углерода. Причина такого изменения показателей качества топлива пока не известна. Широкое распространение получило предположение [34], что в начальный период окисления на поверхности угля образуются продукты окисления, покрывающие свободную поверхность угля слоем, труднопроницаемым для молекулярного кислорода. Отсутствие закономерной связи между склонностью топлива к самовозгоранию и показателями технического и элементного анализов дает право предполагать, что в углях, склонных к самовозгоранию, содержание веществ, способных к окислению при низких температурах, настолько мало, что не оказывает влияния на общепринятые характеристики топлива.

