Реакция взаимодействия водяного пара (H2О) с углеродом имеет в количественном отношении второстепенное значение в процессе, протекающем в восстановительной зоне при горении углерода. В конечных продуктах газообразования на воздушном дутье эта реакция практически не участвует, так как концентрация водяных паров в воздухе обычно незначительна.
В процессе паровоздушной или парокислородной газификации топлива или при сжигании топлива с ограниченным или полуограниченным воспламенением, когда пары, получающиеся из влаги угля, попадают с дутьем в зону горения и в восстановительную зону, разложение H2О на раскаленном углероде оказывает существенное влияние на процесс горения углерода и на газообразование. Реакция H2О+С является основной рабочей реакцией при производстве водяного газа, например в газогенераторах с периодическим процессом, когда слой кокса, нагретый за счет сжигания в дутьевой период при подаче воздуха, реагируете водяным паром в паровой период при подаче водяных паров в раскаленный слой кокса. При подземной газификации угля реакция разложения водяного пара и соответствующая ей реакция конверсии окиси углерода
![]()
имеют и будут иметь, как правило, большое практическое значение.
Изучению реакции разложения водяного пара посвящено не меньшее число работ, чем изучению реакции между углеродом и двуокисью углерода. Экспериментальное исследование реакции H2О+С еще более трудно, чем исследование реакции CO2+С, и все, что было нами сказано в отношении изучения реакции взаимодействия углерода с CO2, в значительной мере справедливо и для реагирования углерода с водяным паром. Как и при изучении реакции CO2+С, основной экспериментальной трудностью является поддержание изотермического температурного режима всей реагирующей углеродной поверхности.
В связи с экспериментальными трудностями, которые подробно были изложены нами выше, большинство работ, посвященных исследованию реакции H2О+С, не могут считаться в количественном отношении сколько- нибудь точными.
Не касаясь здесь обзора этих многочисленных работ, посвященных исследованию скорости и механизма реакции H2О+С, поскольку такие обзоры делались неоднократно 143], [44], отметим только то, что приведенные в них данные обычно характеризовали не процесс как таковой, а его развитие в конкретных условиях, сложившихся в данной экспериментальной установке и, как правило, точно не известных. Такое положение часто не позволяет сравнивать количественные результаты, полученные различными исследователями.
Наиболее точные в количественном отношении данные по реакции H2О+С дают работы сотрудников Хиншельвуда [35], [45] и работа Каржавиной [37], выполненная в лаборатории, руководимой Чухановым.
Большинство работ, включая и отмеченные, показывают, что кинетический характер реакции H2О+С аналогичен характеру реакции CO2+С, и что активность углей, как правило, примерно одинаково характеризуется как по реакции CO2 4~ С, так и по реакции H2О+С.
Для иллюстрации на рис. 34 приведены данные Клемента, Адамса и Хаскинса по интенсивности разложения H2О коксом. Сравнение рис. 42 с рис. 13 показывает однотипность и количественную близость (по порядку величин) интенсивностей реакций CO2+ С и H2О+С по данным этих авторов.
Большая сложность реакции H2О+С обусловлена тем, что она, в отличие от реакции CO2 +С, может идти по двум стехиометрически различным схемам с образованием окиси или двуокиси углерода. Кроме того, реакция восстановления H2О может сопровождаться двумя вторичными реакциями — конверсией окиси углерода (αв) и восстановлением двуокиси углерода, образующейся при восстановлении водяного пара.
Весьма вероятен также и более сложный ход реакции восстановления водяных паров через адсорбционный процесс и образование промежуточного твердого (поверхностного) комплекса СхОуH2у или СХОУ с отщеплением водорода и образованием окиси углерода или обоих окислов углерода.
Результаты правильно поставленных экспериментальных исследований реакции H2О + С, безусловно, позволят раскрыть действительный механизм реагирования. В связи с ограниченным объемом данной монографии, а также недостаточностью экспериментальных данных, мы лишены возможности подробно остановиться здесь на разборе этом важной реакции как в термодинамическом, так и в кинетическом аспектах.

Рис. 34. Влияние времени контакта на степень восстановления водяного пара коксом для различных температур реагирования (по данным Клемента, Адамса и Хаскинса)
1 — кокс; 2 — древесный уголь
Однако основные вопросы реагирования H2О, особенно важные для рассмотрения задачи п. г. у., мы здесь кратко рассмотрим, основываясь главным образом на результатах экспериментальных исследований Каржавиной [371. Исследование реакции H2О+С проводилось в этой работе по той же методике, что и реакции CO2 + С, и это позволило в большей мере, чем в других работах, обеспечить изотермичность реагирования и выполнение соответствующих условий, обязательных для исследования кинетических характеристик такого типа гетерогенных эндотермических реакций.
Экспериментальные исследования влияния скорости газового потока на выход реакции H2О + С, как и следовало ожидать, подтвердили, что при небольших изменениях концентрации H2О за счет реакции скорость газового потока не влияет на суммарную скорость реакции водяного пара с углеродом. Основной цикл исследований был проведен с электродным углем при температуре около 1000°.
Наибольший теоретический и практический интерес представляет, конечно, зависимость выхода реакции от концентрации H2О в реагирующем газе, так как она позволяет решить некоторые важные вопросы, касающиеся механизма этой реакции.
На рис. 35 представлена зависимость выхода окиси углерода от концентрации водяного пара в реагирующей смеси N2 + НгО при взаимодействии с пятимиллиметровым слоем частиц электродного угля размером 2—3 мм при температурах 1000 и 1040°. Полученная зависимость выхода СО от концентрации H2О представляет исключительный интерес. Как видно из рисунка, увеличение концентрации водяного пара (H2О) в реагирующем газе свыше 25—30% с практически достаточной точностью не влияет на скорость реакции H2О+С.

Рис. 35. Влияние концентрации водяных паров на выход окиси углерода при 1000 и 1040° (реакция с электродным углем)
Размер частиц —2-3 мм; навеска —0,77 г; дутье — Η2Ο4+Ν2; расход дутья — 150 см3/мин
При этом следует подчеркнуть, что при низких концентрациях H2О ее непрореагировавший остаток составлял всего 5—7% из 23% в начальной смеси, в то время как при максимальной концентрации остаток не разложившейся H2О превышал 50—60% от исходного. Таким образом, абсолютный выход реакции не снижался, несмотря на то, что при низких концентрациях H2О в реагирующем газе создавались весьма неблагоприятные условия для реакции из-за большого содержания СО в газе, в несколько раз превышающего относительную концентрацию1 СО при высоких исходных концентрациях H2О. Относительный выход реакции2 при низких концентрациях H2О увеличивался в несколько раз. Характер полученной зависимости отвечает реакции, имеющей практически почти нулевой порядок по H2О. Для сравнения на рис. 36 приведен полученный Каржавиной в этой же работе для тех же условий график зависимости выхода СО по реакции CO2+С от средней концентрации двуокиси углерода в реагирующем газе.
Сравнение рис. 35 и 36 показывает, что скорости реакций H2О+С и CO2+С по выходу СО при высоких концентрациях CO2 и H2О практически одинаковы, в то время как при низких концентрациях реакция H2О+С идет значительно быстрее. Реакция CO2+Спри 1000 и особенно при 1040°, в отличие от реакции С+H2О, ближе к первому порядку по CO2, чем к нулевому.
1 Абсолютная концентрация СО в газе была приблизительно одинакова при всех исследованных начальных концентрациях H2О.
2 Выход CO2 при реагировании H2О с углеродом был незначительным, выход СО фактически показывал выход реакции по углероду и кислороду.
Это исключительно важное положение особенно ярко выражено на рис. 35 и 36 для реагирования H2О и CO2 с углеродом при температуре 1040°, когда реакция CO2 + С, как отмечалось в предыдущем разделе, имеет суммарный макрокинетический порядок по CO2, близкий к первому, поскольку скорость реакции разложения поверхностного комплекса СхОу сильно влияет на суммарную скорость процесса.
Реакция разложения пара и при 1040° имеет практически еще далекий от первого порядок по H2О. Характерно, что суммарная скорость реакций CO2+С и H2О + С по окиси углерода практически почти одинакова для высоких концентраций CO2 и H2О также и при этой температуре реагирования.
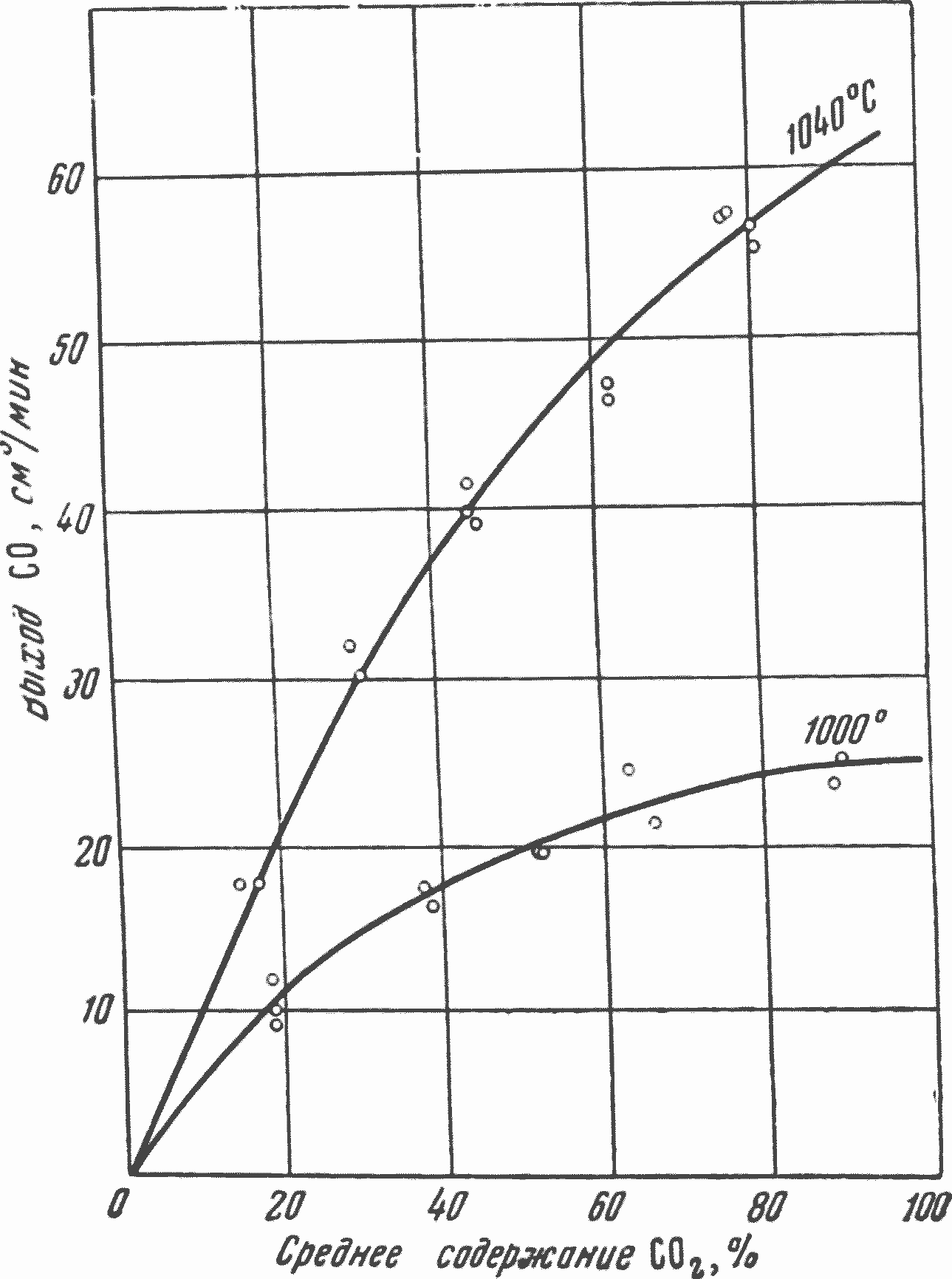
Рис. 36. Влияние концентрации CO2 на выход окиси углерода при 1000 и 1040° (реакция с электродным углем)
Размер частиц —2—3 мм; навеска — 0,77 г; дутье — CO2+N2; расход дутья — 150 см/мин
Скорость реакции H2О + С достаточно сильно изменяется при добавках СО и H2, как и скорость реакции CO2+С при добавке СО. Это явление, наряду с нулевым порядком реакции H2О + С, убедительно указывает на то, что данная реакция, как и реакция CO2+С, идет через адсорбционный процесс с торможением его за счет адсорбции продуктов реакции. Наиболее важным экспериментальным фактом, впервые обнаруженным Каржавиной при исследовании реакции восстановления двуокиси углерода и водяного пара, является резкое взаимное влияние этих реакций. Обычно при расчетах совместного восстановления двуокиси углерода и водяного пара суммировались результаты, получаемые при раздельном протекании этих реакций. Опыты Каржавиной показали, что такой расчет является ошибочным.
На рис. 37 приведены результаты исследования реагирования двуокиси углерода при разбавлении ее водяным паром.
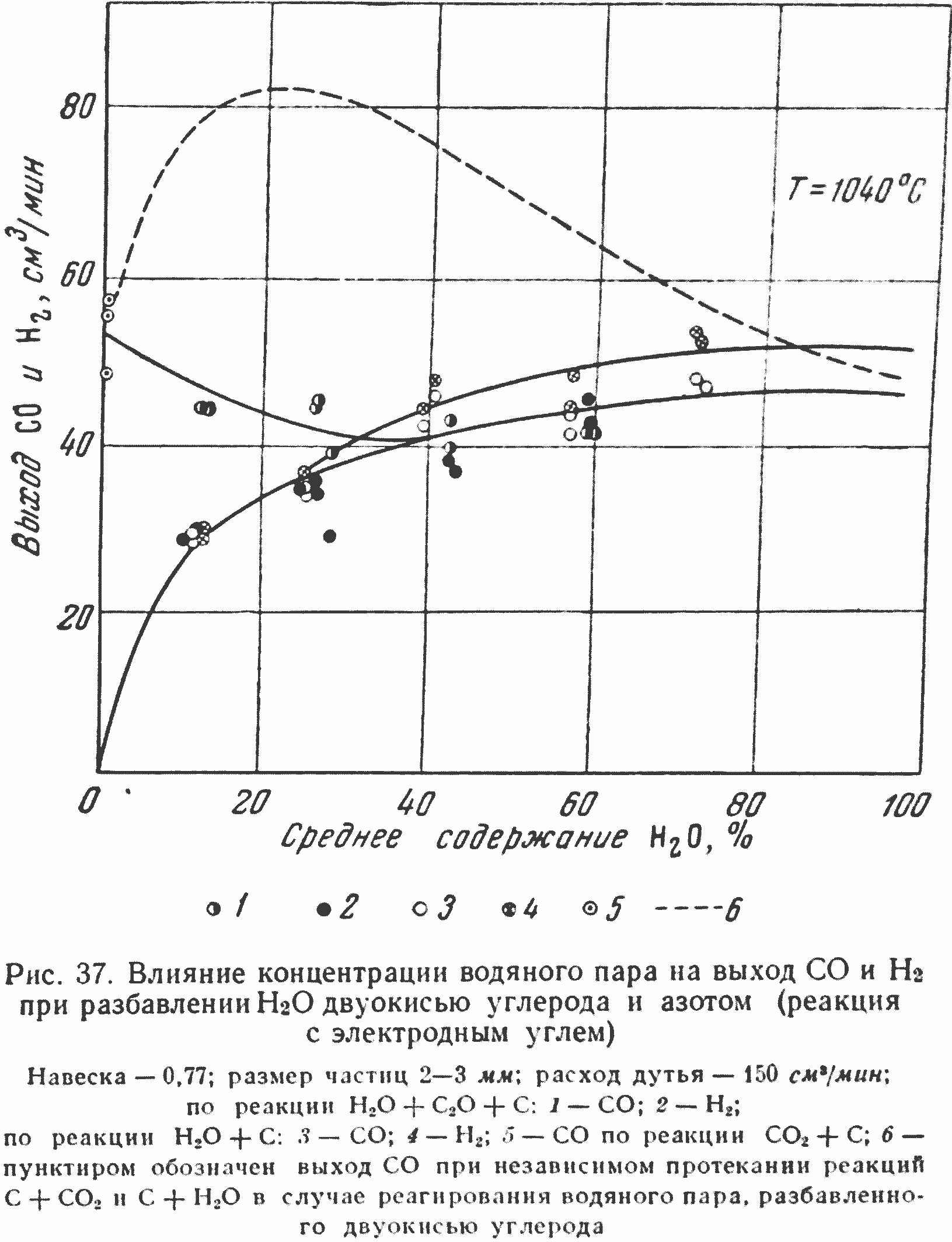
Кривая, относящаяся к реагированию углерода при наличии смеси H2О и CO2, показывает, что добавка CO2 в качестве разбавителя водяного пара фактически не действует на выход окиси углерода при концентрациях H2О выше 20%. Сравнивая выход СО по реакциям H2О +N2+С и H2О+CO2+С, мы видим, что при концентрациях водяного пара в азоте свыше 20—30% кривые выхода СО совпадают с кривыми выхода СО при разбавлении H2О двуокисью углерода. Вместо двойного выхода СО при смеси CO2 и H2О, как это следует за счет суммирования выхода двух реакций при раздельном их протекании (пунктирная кривая), фактически получен такой выход, как если бы в газе имелось либо 70% CO2, либо 30% H2О. Выход водорода получается при этом почти такой же, как в случае реагирования углерода с водяным паром, разбавленным азотом.
Как видно из рис. 38, ход газообразования при 1000 аналогичен газообразованию при 1040. Присутствие водорода при реакции восстановления CO2 несколько увеличивает скорость образования окиси углерода за счет реакции обратной конверсии окиси углерода.
Остановимся на выводах, которые могут быть сделаны о характере реакции взаимодействия водяного пара с углеродом по результатам имеющихся экспериментальных исследований и, в первую очередь, работ Каржавиной, Годсби, Лонга и Сайкса. Мы уже отмечали, что реакция H2О+С идет через хемосорбционный процесс. Основываясь на описанном выше факте зависимого развития реакции CO2+С и H2О+С, можно предпо ложить, что обе реакции идут как одна реакция, например реакция H2О+С с последующим взаимодействием водорода с двуокисью углерода у поверхности кокса, либо что обе реакции протекают на одних и тех же «активных» участках поверхности углерода. Решение этого вопроса имеет существенное значение для изыскания путей управления ходом обеих реакции.

Еще из работ X. Б. Бекера [46] было известно, что присутствие даже незначительных концентраций водяных паров в реагирующей двуокиси углерода резко интенсифицирует реакцию CO2 + С. Прямое исследование реакции H2 + CO2 в присутствии углеродной поверхности не дает еще достаточных оснований для представления механизма реакции восстановления двуокиси углерода как реакции взаимодействия CO2 с водородом и реагирования образующейся при этом H2О с углеродом. Такому ходу процесса противоречит также то обстоятельство, что выход водорода при совместном реагировании CO2 и H2О с углеродом аналогичен его выходу при реагировании с углеродом одного водяного пара. В самом деле, если бы реакция восстановления CO2 шла через окисление водорода, то выход водорода при совместном реагировании должен был бы сильно снизиться при неизменном выходе окиси углерода. Одинаковый выход водорода в обоих случаях свидетельствует о том, что восстановление CO2 идет в обычных условиях непосредственно на поверхности углерода. При совместном восстановлении CO2 и H2О с большим преобладанием протекает реакция H2О + С, в то время как реакция CO2+С почти остановлена. Такой ход процесса, несомненно, связан с различными адсорбционными характеристиками CO2 и H2О.
Водяные пары адсорбируются углеродом более интенсивно и удерживаются, очевидно, более прочно, так что вытесняют двуокись углерода с поверхности углерода. В равновесном процессе идет непрерывная адсорбция и десорбция, при этом H2О более прочно адсорбируется углеродом, быстро занимает всю активную поверхность, вытесняя CO2. Более активные «краевые» атомы углерода, способные образовывать поверхностный комплекс как с H2О, так и с CO2, оказываются целиком занятыми молекулами H2О при достаточном количестве паров воды. Поверхностный комплекс, разлагаясь, образует окись углерода, которая, видимо, и является первичным окислом углерода реакции взаимодействия углерода с водяным паром. Характерной особенностью реакции H2О+С, как отмечалось, является то, что выход окиси углерода в ней равен выходу окиси углерода по реакции CO2+С при высоких концентрациях CO2, т. е. при полном насыщении поверхности углерода адсорбированной двуокисью углерода. Эта особенность связана, видимо, с тем, что поверхностный комплекс образуется на краевых атомах углерода из двух или четырех атомов кислорода (из H2О), и, соответственно, при хемосорбции CO2 эти же краевые атомы образуют комплекс с тем же количеством кислорода. При разложении такого комплекса возникает окись углерода, водород же в случае реакции H2О+С выделяется, вероятно, в процессе образования поверхностного комплекса СХОУ.
Нулевой или близкий к нулевому порядок реакции взаимодействия водяного пара с углеродом указывает на то, что основным лимитирующим этапом реакции является процесс образования поверхностного комплекса из адсорбированных на углероде молекул воды. Процессы адсорбции H2О и разложения комплекса СХОУ практически не тормозят суммарного реагирования водяного пара с углеродом. В этих же условиях суммарная осредненная константа скорости реакции H2О + С будет в значительной степени определяться величиной К0 константы образования поверхностного комплекса, аналогичной К0 (уравнение 28) для реакции CO2+С.
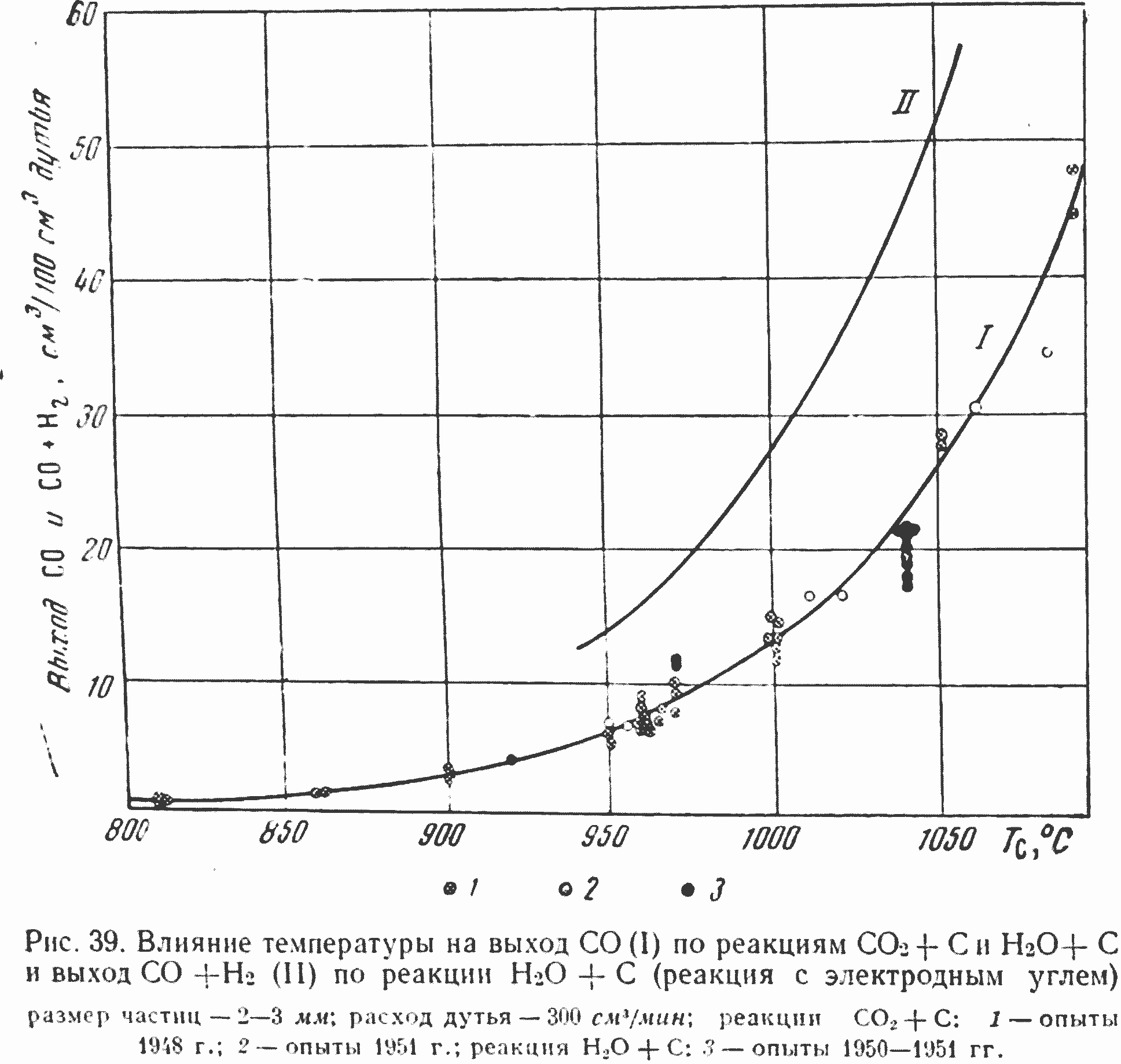
Так как образование комплекса СХОУ и по реакции H2О+С и по реакции CO2 + С протекает на одних и тех же краевых атомах углерода, то абсолютные значения К0 и К0' и их температурные зависимости должны быть близкими. В связи с тем, что при высоких концентрациях CO2 и H2О суммарные константы скорости реакций близки К0 и К0'. должны быть близки и между собой и скорости самих реакций. Этот вывод целиком подтверждается результатами экспериментальных исследований. Мы уже отмечали, что в этих условиях опытные значения выхода СО для обеих реакций совпадают, т. е. совпадают скорости образования поверхностных окислов и из адсорбированных CO2 и H2О. На рис. 39 приведены экспериментальные данные по выходу окиси углерода при разных температурах, полученные Каржавиной при реагировании электродного угля с СОг и НгО.
Как видно из рисунка, все опытные данные с удовлетворительной точностью ложатся на одну кривую. Учитывая, что электродный уголь для опытов использовался из различных партий, имеющийся разброс точек можно считать вполне допустимым и удовлетворительно подтверждающим сделанный вывод. Некоторое различие в кинетических характеристиках обеих реакций возможно также в связи с образованием водорода при восстановлении водяного пара.
Таким образом, на основании приведенных данных и других исследований можно некоторые вопросы, касающиеся механизма и кинетических характеристик реакции H2О+С, считать в первом приближении разрешенными.
Реакция H2О+С идет по следующей наиболее вероятной макросхеме.
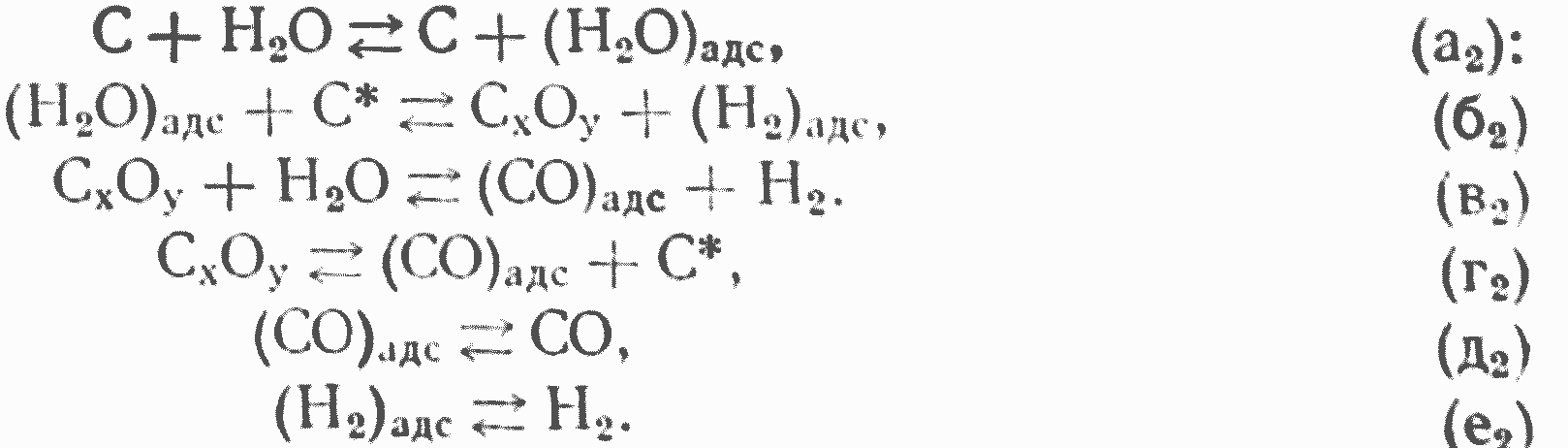
В обычных условиях, при температуре — 1000°, реакция имеет практически почти нулевой порядок по H2О и тормозится адсорбцией продуктов реагирования. Скорость реакции при температурах 1000—1100 определяется этапом (б2) образования комплекса СХОУ и по выходу СО равна скорости разложения CO2 на углероде при высоких концентрациях CO2.
Реакция H2О+С протекает, вероятно, независимо от реакции CO2+С, но сама почти целиком прекращает ее при достаточных концентрациях (более 15—25%) H2О в реагирующем газе даже в том случае, когда концентрация CO2 в этом газе достигает 70—80%.
Если сравнение суммарной скорости реакций CO2+С и H2О+С (протекающих отдельно) при высоких начальных концентрациях CO2 и H2О дает (по выходу СО) одинаковые величины, то при снижении начальных концентраций CO2 и H2О положение резко меняется. При низких концентрациях CO2 суммарная скорость образования СО в результате реакций начинает снижаться за счет торможения процесса разложения комплекса СХОУ, в то время как скорость реакции восстановления H2О почти не изменяется. При низких концентрациях CO2 и H2О при раздельном протекании реакций CO2+С и H2О+С скорость реакции H2О+С на одном и том же сорте кокса (углерода) в несколько раз выше, чем реакции CO2+С.
При совместном протекании этих двух реакций газификации замеряемая скорость реакции H2О+С в несколько раз больше, чем реакции CO2 + С, так что в этом случае вначале протекает почти полностью реакция H2О+С, а реакция восстановления CO2 продолжает протекать и после израсходования значительной части H2О.
Таким исключительно важным для процесса горения и особенно процесса газификации фактом совместного протекания этих реакций газификации объясняется получение высокой концентрации CO2 при газификации на паровоздушном или парокислородном дутье с высоким содержанием H2О. Этот факт обычно объясняли только протеканием реакции конверсии окиси углерода в избытке водяных паров. Этим же свойством реакций объясняется на паро-воздушном дутье и более быстрый рост концентрации водорода, чем окиси углерода (в восстановительной зоне) с достаточно четко, как правило, выделяемой последовательностью этих реакций, чему обычно также не придавалось должного значения.
При анализе теплового режима процессов горения и газификации мы увидим, что эта особенность реакций CO2+С и H2О+С имеет исключительно большое практическое значение, особенно для процесса подземной газификации углей.
Ограничиваясь представленными здесь материалами по характеристике реакции восстановления водяного пара углеродом, мы дополнительно лишь отметим, что все характеристики, определяющие области гетерогенного реагирования реакции H2О+С, в принципе (с учетом изменения скорости реакции) аналогичны характеристикам, изложенным нами в предыдущем разделе для реакции восстановления двуокиси углерода. Надо отметить, однако, что реакция H2О+С изучена сейчас еще меньше, чем CO2+С,

