3. ЗНАЧЕНИЕ ХИМИЧЕСКОГО МЕХАНИЗМА В ПРОЦЕССЕ ГОРЕНИЯ
Мы уже отмечали, что третьим основным законом горения углерода кокса является одновременное образование окиси и двуокиси углерода в качестве первичных продуктов взаимодействия углерода с кислородом. Естественно, прежде всего, возникает вопрос, имеет ли практически какое-либо значение величина отношения этих первичных окислов. Чтобы ответить на этот вопрос, дадим четкое и однозначное определение понятия первичных продуктов реакции взаимодействия углерода с кислородом.
Первичными газообразными продуктами горения углерода являются те окислы, которые в результате взаимодействия углерода с кислородом впервые (первыми) покидают поверхность углерода.
При реагировании углерода с кислородом возможны следующие комбинации реакций, в результате которых могут образоваться в качестве первичных продуктов окись и двуокись углерода:
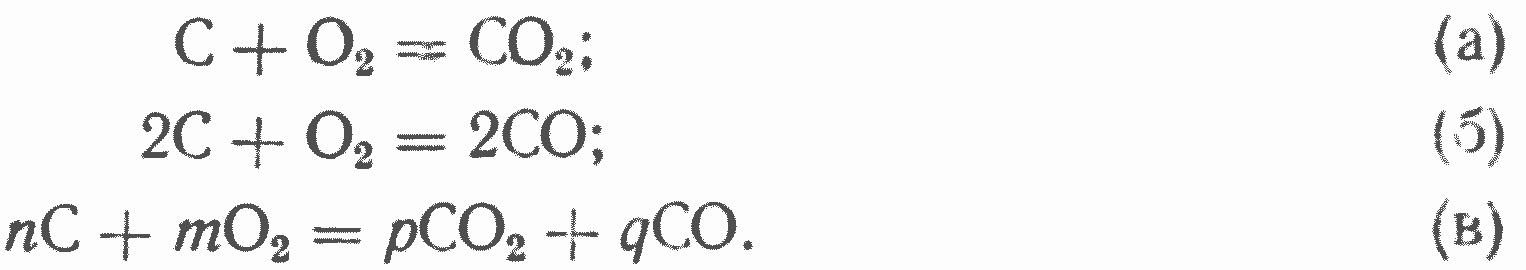
В связи с образованием в кислородной зоне окислов углерода и присутствием в дутье кислорода и водяных паров* наряду с первичными будут всегда протекать и вторичные реакции
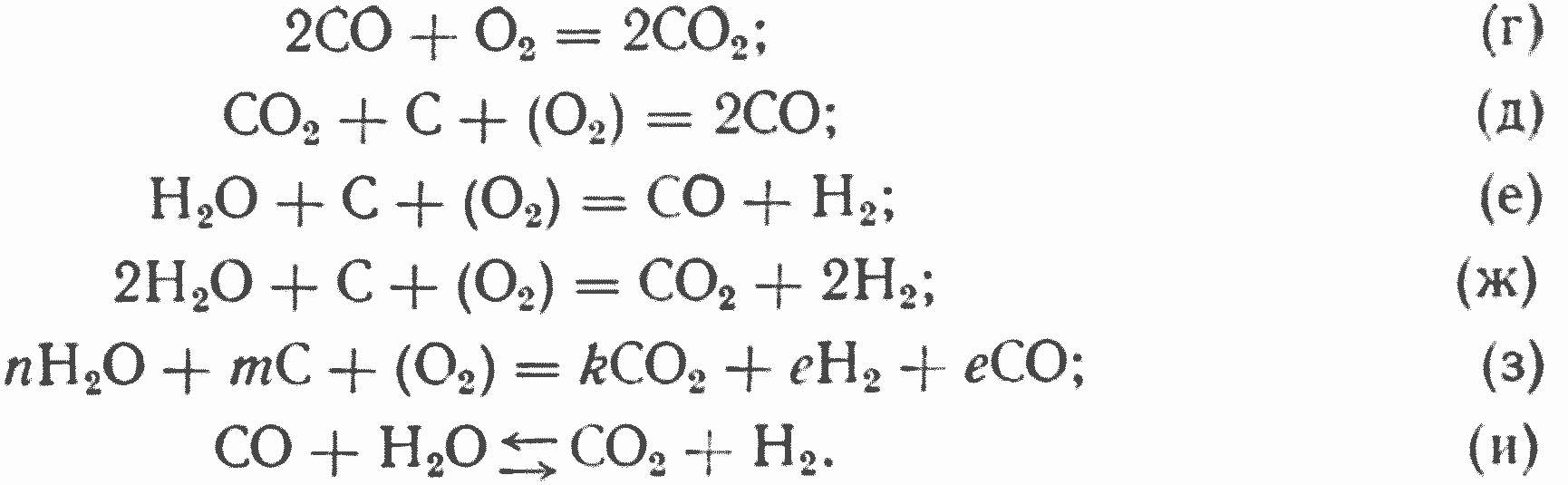
При низких концентрациях водяных паров в дутье реакции (е), (ж) (з) и (и) существенного значения в газообразовании иметь не будут, однако водяной пар может выполнять роль «посредника» при «выжигании» углерода и в этом случае. Рассматривая протекание первых пяти реакций, можно убедиться, что характер первичных реакций и отношение СО/CO2 в первичных продуктах горения углерода имеют существенное значение не только для газообразования, но и для интенсивности расходования кислорода, и, следовательно, протяженности кислородной зоны во всех пяти областях гетерогенного реагирования. Очевидно, что в первых трех областях гетерогенного реагирования (чисто кинетической, первой переходной и кинетической) характер химической реакции будет иметь прямое влияние как на газообразование, так и на интенсивность процесса потому, что здесь ход химической реакции непосредственно влияет на интенсивность горения.

Рис. 6. Распределение концентраций реагирующих газов внутри и вне горящего сферического тела
1 — СО; 2 — CO2; 3 — О2; 4 — граница поверхности шара (остальные обозначения — в тексте)
Во второй переходной области это прямое влияние резко ослаблено, а в диффузионной области им можно совершенно пренебречь, хотя и здесь отношение СО/CO2 может существенным образом влиять на интенсивность выгорания углерода кокса, так как в случае образования чистой СО на каждую порцию кислорода, подведенного к поверхности, углерода будет выгорать в два раза больше, чем в случае образования исключительно углекислоты. Изменение отношения СО/CO2, как ясно из экзотермических эффектов и теплового баланса процесса, будет существенным образом влиять на температурный режим горения углерода со всеми вытекающими отсюда последствиями.
Сильное влияние отношения первичных окислов углерода на интенсивность его горения зависит существенным образом от протекания вторичных реакций (г) и (д), смазывающих действие первичных реакций.
Для иллюстрации влияния вторичных реакций на характер газообразования при горении сферической частицы электродного угля диаметром 15 мм приводим на рис. 6 распределение концентраций О2, CO2 и СО внутри и вне углеродной частицы.
На рис. 6 принято, что первичным продуктом взаимодействия углерода с кислородом является окись углерода. Кривые на рисунке построены с учетом приближенных кинетических характеристик реакций С + О2, CO2 + С и С О + О2 и даны для четырех температурных режимов: 600 (а), 1000 (б, в), 1600 (г) и 2100° С (д). Для 1000° приведены по приближенным экспериментальным данным автора [9] два графика: один (б) при скорости реакции горения СО, равной нулю (v1=0), т. е. без догорания окиси углерода, и другой (в) с учетом догорания (v1=8). Сравнивая эти графики, мы видим резкое различие в газообразовании как внутри, так и вне углеродных частиц. Несмотря на то, что в обоих случаях первичным продуктом является исключительно окись углерода, в одном случае мы имеем в качестве конечного продукта чистую окись углерода, а в другом — почти чистую двуокись — продукт вторичной реакции (г).
Окись углерода в частице и тем более в газовом объеме во втором случае практически полностью отсутствует, так как первичная окись углерода успевает догорать, в то время как вторичная реакция (б) восстановления CO2 при этой температуре практического значения в процессе газообразования не имеет даже при большой внутренней реакционной поверхности. График (а), показывающий характер газообразования при 600 С, иллюстрируя значительное снижение суммарной скорости процесса, свидетельствует также о том, что при малой скорости горения окиси углерода (невоспламененного горения СО) последняя практически полностью сохраняется*, но концентрация ее в газовом объеме невелика.
*В расчете не учтена реакция гетерогенного (на поверхности углерода) горения киси углерода, которая, по данным автора, при этих температурах и при наличии активирующих добавок золы имеет существенное значение.
Характер процесса газообразования достаточно сильно изменяется при переходе к высоким температурам горения (1600 и 2100°С). При этих температурах заметное влияние оказывают обе вторичные реакции, горение окиси углерода и основная реакция газификации (восстановление углекислоты).
При 1600 С кислород практически не проникает до центра углеродной частицы, и поэтому сохраняется окись углерода, образующаяся как в результате первичной реакции, так и в результате восстановления двуокиси углерода, и концентрация окиси углерода внутри частицы высока. На внешней поверхности углеродной частицы концентрация окиси углерода низка, так как окись углерода с большой скоростью (с образованием пламени) реагирует с кислородом. В газовом объеме при этом, несмотря на образование первичной окиси углерода, присутствует практически только двуокись углерода. Интенсивность выгорания углерода при переходе от 1000 до 1600°С изменяется сравнительно незначительно.
При температуре 2100°С наблюдается уже новое весьма интересное явление совмещенного горения углерода за счет кислорода и за счет CO2, т. е. за счет реакции восстановления двуокиси углерода, протекающей уже с практически заметной скоростью. Как видно из рис. 6, при 2100 внутри частицы практически присутствует только окись углерода, которая на поверхности частицы составляет также примерно две трети окислов. Кислород лишь в небольшом количестве достигает поверхности углеродной частицы, а большая часть его расходуется на горение окиси углерода в газовом объеме. Выгорание углерода идет в этих условиях, по данным Л. Н. Хитрина, в значительной мере за счет восстановления двуокиси углерода по схеме Бурке и Шумана [23].
Для точного представления о ходе процесса горения в этих условиях необходимо, однако, дать некоторые пояснения. Как мы покажем в дальнейшем, при реагировании двуокиси углерода с углеродом в диффузионной области происходит резкое снижение температуры реагирующей поверхности углерода, достигающее при сухом воздушном дутье 800—900° С (т. е. при температуре в зоне горения — 2100 С температура поверхности углерода в восстановительной зоне должна снижаться до 1200—1300° С). Однако при таком снижении температуры реакция CO2+С выходит из диффузионной области, и процесс должен резко замедлиться, что неминуемо приведет к усилению подвода кислорода к поверхности углерода и тем самым к нарушению горения углерода по схеме Бурке и Шумана. Следовательно, в этих условиях, т. е. на воздушном дутье (до 2300—2500 С), горение углерода вообще не может идти полностью по реакции CO2+С, и кислород всегда будет в какой-то части доходить до реакционной поверхности углерода или, во всяком случае, до области газового объема, расположенной исключительно близко к этой поверхности, таким образом, чтобы кондуктивный подвод тепла, получаемого при горении СО2, мог обеспечивать поддержание высокой температуры реагирующего углерода.
Очевидно так же, что если для 600 гидродинамический режим будет слабо влиять на характер концентрационных кривых при горении углерода, то для всех остальных температур гидродинамика потока и, в частности, характер обтекания частицы дутьем и скорость газового потока будут существенно отражаться не только на интенсивности горения, но и на концентрационных полях. Предположим, что в процессе горения при 1000° мы будем постепенно увеличивать скорость газового потока. Это приведет к повышению интенсивности подвода кислорода к поверхности углерода и к повышению его концентрации на внешней, контурной поверхности частиц. В связи с резким увеличением количества образующейся первичной окиси углерода и практически неизменным (при данной температуре) суммарным образованием двуокиси углерода концентрация окиси углерода на поверхности частицы повысится и снижение ее в газовом объеме будет более медленным.
Если эту горящую сферическую коксовую частицу поместить не в безграничном объеме реагирующего газа, а окружить другими горящими коксовыми (углеродными) частицами, например, в кипящем (псевдоcжиженном) или в плотном слое, то изменение скорости газового потока приведет неизбежно к радикальным изменениям процесса газообразования в горящем слое и на выходе из него.
Расчет процесса газообразования в различных участках горящего слоя, канала газовзвеси и т. д. требует учета протекания как первичных, так и вторичных реакций. Наиболее сложный характер имеет газообразование в кислородной зоне горения, т. е. там, где концентрация кислорода превышает 5—10% начальной или 1—2% при воздушном дутье.
Для того, чтобы выявить и учесть в расчетах первичные реакции горения углерода кокса, необходимо знать кинетические характеристики основных первичных и вторичных реакций, всегда в той или иной степени сопровождающих горение углерода.
Изучение вторичных реакций менее сложно, чем изучение первичного взаимодействия углерода с кислородом, потому что вторичные реакции принципиально могут быть экспериментально исследованы в чистом виде, что практически неосуществимо для горения углерода. Для интересующих нас процессов газификации, в частности, подземной газификации углей, как мы в дальнейшем покажем, наибольшее практическое и теоретическое значение имеет реакция восстановления двуокиси углерода, в связи с чем мы рассмотрим здесь ее более подробно. Меньшее значение для п. г. у. при нормальной организации процесса имеет реакция горения окиси углерода, практически целиком протекающая в кислородной зоне при наличии в ней окиси углерода. Рассмотрение этой реакции важно постольку, поскольку необходимо оценить ее сравнительно пассивную роль в процессах газификации в подземных условиях фактически при всех известных методах п. г. у.

