Глава I I
ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕОРИИ ГОРЕНИЯ И ГАЗИФИКАЦИИ КОКСА ТВЕРДЫХ ТОПЛИВ
1. ОБЩИЕ ХАРАКТЕРИСТИКИ ПРОЦЕССА
Подземная газификация представляет собой комплекс мероприятий, рассчитанный на превращение угля в горючий газ под землей путем воздействия на раскаленный уголь воздушным, паровым или обогащенным кислородом дутьем. Нагретый до высокой температуры (выше 500°С) уголь (сланец) подвергается термическому разложению, при котором выделяются газопарообразные летучие продукты и образуется горячий коксовый остаток, содержащий в горючей части в основном углерод. При так называемой безостаточной газификации, о которой мы здесь главным образом и говорим, основным процессом, фактически предопределяющим успех организации п. г. у., является горение углерода, т. е. реагирование кислорода дутья с углеродом кокса, сопровождающееся реакциями взаимодействия горючих газов с кислородом, а также CO2 и H2О с углеродом, а процессы сушки угля, образования летучих веществ и получения коксового остатка, хотя и имеют существенное значение, но все же являются второстепенными, подчиненными.
Освоение процесса горения кокса в условиях работы подземных газогенераторов практически приведет к овладению основными процессами п. г. у. и созданию, если это вообще возможно, управляемых, достаточно надежно работающих промышленных панелей для производства газа удовлетворительного состава с возможно более высокой степенью использования потенциального тепла топлива, находящегося в пласте. Управление горением кокса угольного пласта в большинстве случаев, несомненно, позволит путем сравнительно простых мероприятий организовать соответствующим образом процессы прогрева, сушки и термического разложения угля.
При этом, однако, возникает основной вопрос о возможности в достаточной степени управлять процессом горения и газификации в сложных условиях работы подземного газогенератора, не имеющего стенок, ограничивающих его объем, и в значительной мере зависящего от поведения окружающих пород и целика самого топлива. Чтобы ответить на этот главный, принципиальный вопрос, необходимо рассмотреть основные положения теории горения и газификации углерода кокса и оценить в соответствии с этим возможности и пути создания управляемого процесса и. г. у. при достаточно правильной оценке поведения горных пород, окружающих угольный пласт, и, если возможно, активном воздействии на эти породы.
Первой задачей теоретических исследований горения углерода является изучение физического и физико-химического механизма процесса и создание системы расчета концентрационных, температурных и скоростных полей применительно к конкретным условиям организации процесса. Такая система позволит выбрать наивыгоднейший режим заданного технического процесса, а следовательно, и создать, если это возможно, эффективные управляемые аппараты, работающие с высокой интенсивностью.
Если в большинстве промышленных аппаратов скоростные поля задаются физическими и конструктивными условиями организации процесса горения, то концентрационные и температурные поля являются функцией формирования и развития гидродинамических условий и химизма комплекса процессов, с которыми связано горение углерода. Следует подчеркнуть, что в условиях п. г. у. вопрос формирования скоростных полей, т. е. гидродинамики потока, является особенно важным и в то же время, пожалуй, наиболее сложным.
Длительное время существовало два резко различных направления в развитии теории горения — химическое, в котором основное влияние на суммарную скорость процесса приписывалось скорости химических реакций, и физическое, в котором учитывалась главным образом скорость физических процессов переноса реагирующего газа и продуктов реакции (О2, CO2 и СО).
В Советском Союзе ведущее положение в разработке вопросов физики горения твердых топлив занимала школа, руководимая А. С. Предводителевым. Работы Предводителева и его сотрудников В. И. Блинова, Л. Н. Хитрина и О. А. Цухановой сыграли важную роль в создании физических основ теории горения углерода.
Большое значение для разработки теории горения твердого топлива имели работы, выполненные Г. Ф. Кнорре с сотрудниками, а также Д. А. Франк-Каменецким, Б. В. Канторовичем, М. К. Гродзовским и др.
Впервые попытка теоретически рассчитать интенсивность горения углерода с учетом как скорости химических реакций, так и скорости диффузионного процесса была осуществлена в 1933 г. в Советском Союзе проф. В. И. Блиновым и одновременно и независимо в США — Тю, Девисом и Хоттелем. Этими работами было положено начало, несомненно, наиболее правильного направления в развитии теории горения углерода, позволившего установить первый основной закон гетерогенного горения, который можно сформулировать следующим образом.
Интенсивность суммарного процесса горения углерода теоретически всегда зависит как от кинетики — скорости химического реагирования*, — так и от интенсивности подвода и отвода реагирующих газов и продуктов реакции, количественное влияние этих двух резко различных по своему характеру факторов зависит от конкретных условий горения.
*Точнее — от скорости физико-химического процесса.
Долгое время считалось очевидным и совершенно достоверным, что реакция горения углерода кокса протекает только на внешней, контурной поверхности углеродных частиц, и, в соответствии с этим, велись все расчеты удельной скорости процессов горения углерода, восстановления двуокиси углерода и других аналогичных гетерогенных реакций. В 1932—1933 гг. автором при исследовании окисления и горения газовзвеси древесного угля 151, 19] было открыто так называемое внутреннее реагирование при протекании гетерогенных реакций. Было установлено, что гетерогенные реакции протекают в объеме пористых твердых веществ, и, в частности, реакция между углеродом и кислородом происходит как на внешней, так и на внутренней реакционной поверхностях макро- и частично микропор углерода. Для реакции взаимодействия углерода с двуокисью углерода это явление было экспериментально подтверждено в 1938 г. в работе Мейерса [10].
В 1937—1941 гг. под руководством автора был выполнен ряд специальных исследований внутреннего реагирования углерода с кислородом и двуокисью углерода [11], [12], [13].
Н. В. Лавров [11] наряду с кинетическими провел микроскопические исследования, показавшие характер изменения внутренних пор реагирующего углерода.
В настоящее время вторым основным законом гетерогенного горения углерода и вообще реагирования твердых пористых веществ с газами, парами и жидкостями следует считать закон внутреннего реагирования, который может быть сформулирован следующим образом.
Горение углерода кокса теоретически всегда протекает как на внешней, контурной поверхности кокса, так и на внутренней поверхности макро- и микропор, доступных молекулам реагирующих кислорода, двуокиси углерода, паров воды и окиси углерода количественная роль внутреннего реагирования для различных реакций различна и определяется конкретными условиями реагирования и, в частности, горения углерода.
С самого начала изучения процесса горения одним из важнейших вопросов, который пытались разрешить исследователи, являлся вопрос о характере первичных газообразных продуктов горения углерода. На протяжении долгого периода времени существовала теория первичного образования двуокиси углерода, затем была развита теория первичного образования окиси углерода и, как это ни странно, многие годы эти теории существовали одновременно.
В 1910 г. впервые в работах Рида и Уилера [14] была развита теория одновременного образования обоих окислов углерода. Последующие работы Л. Мейера [15], Сивонена [16], З. Ф. Чуханова [17], М. К. Гродзовского [18], Н. А. Каржавиной [19] и др. [5] подтвердили справедливость этой теории. Однако исследования различных авторов, как мы увидим далее, не привели к возникновению общепризнанного единого представления о химизме процесса горения углерода, но практически все исследователи пришли к общему выводу, который можно считать третьим основным законом горения углерода и сформулировать следующим образом.
Горение углерода в результате взаимодействия углерода с кислородом теоретически всегда дает в качестве первичных газообразных окислов как окись, так и двуокись углерода.
О соотношении окислов углерода и его зависимости от температуры и других условий горения углерода кокса исследователи, как уже говорилось, еще не пришли к единому мнению, и здесь имеются различные теоретические схемы. Из первого и второго законов горения следует, что горение углерода теоретически всегда протекает во всем объеме углеродных частиц, а интенсивность горения определяется как скоростью переноса (диффузии) реагирующих газов, так и кинетикой химических реакций.
* Для других гетерогенных реакций — соответствующим компонентам, участвующим в реакции.
Практически, однако, роль отмечаемых этими двумя законами факторов различна, и поэтому оказалось целесообразно и удобно выделить [20] в процессе горения углерода различные области, характеризующиеся определенным количественным влиянием различных факторов на суммарную интенсивность горения углерода и на соответствующие закономерности изменения скорости процесса. Для выяснения физической сущности такого разграничения процесса горения углерода и для иллюстрации практической ценности и удобства этого деления рассмотрим процесс взаимодействия отдельной сферической частички углерода с потоком газа, содержащим кислород, сильно разбавленный инертным газом, например, азотом.
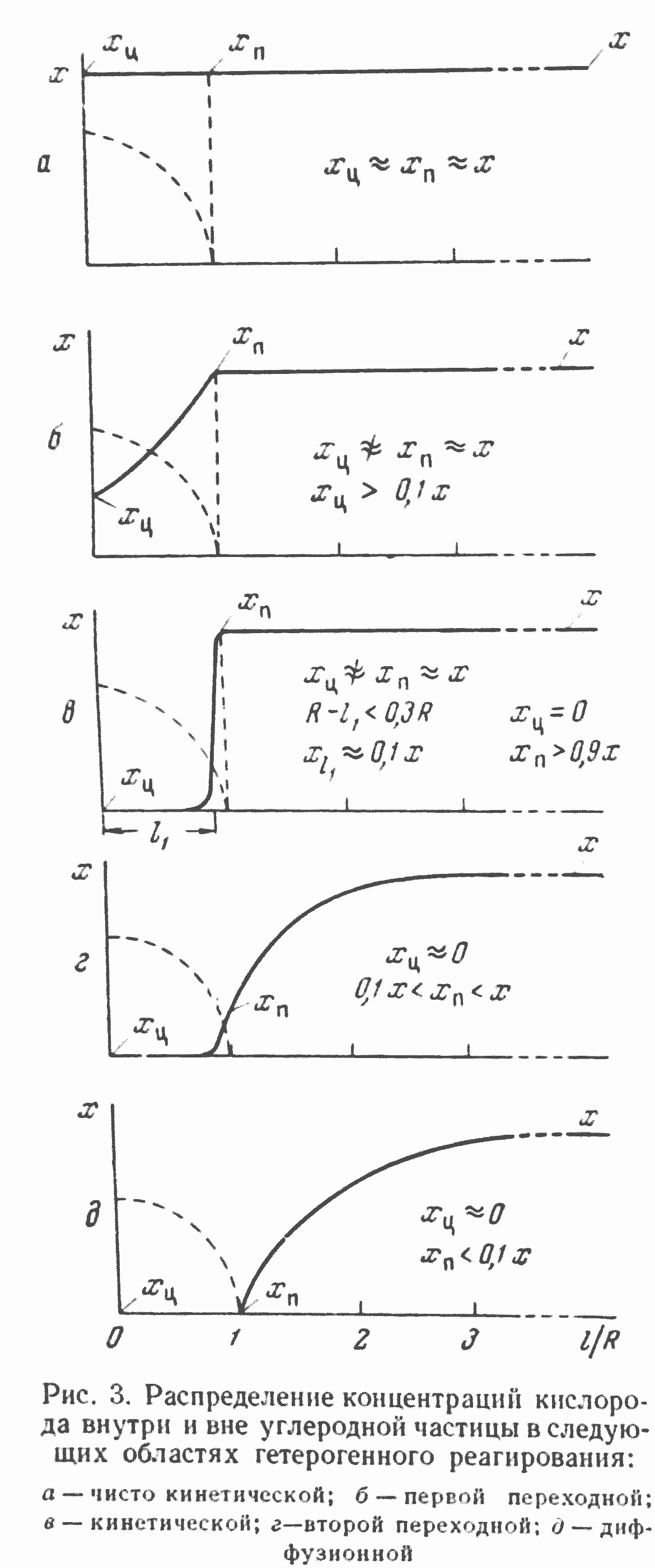
При низкой температуре, когда скорость химической реакции между углеродом и кислородом небольшая, суммарная скорость процесса с практически достаточной точностью определится скоростью химической реакции, протекающей на всей доступной для кислорода поверхности макро- и микропор углерода. В связи с малой суммарной скоростью процесса горения подвод кислорода из газового объема к внешней поверхности частиц и даже внутрь частиц, в поры обеспечивается при небольшом перепаде концентрации кислорода, так что концентрации кислорода в потоке газа (х) на внешней, контурной поверхности углеродной частицы хп и в центре частицы углерода хц можно считать (рис. 3, а) практически равными х≈хп≈хц.
![]()
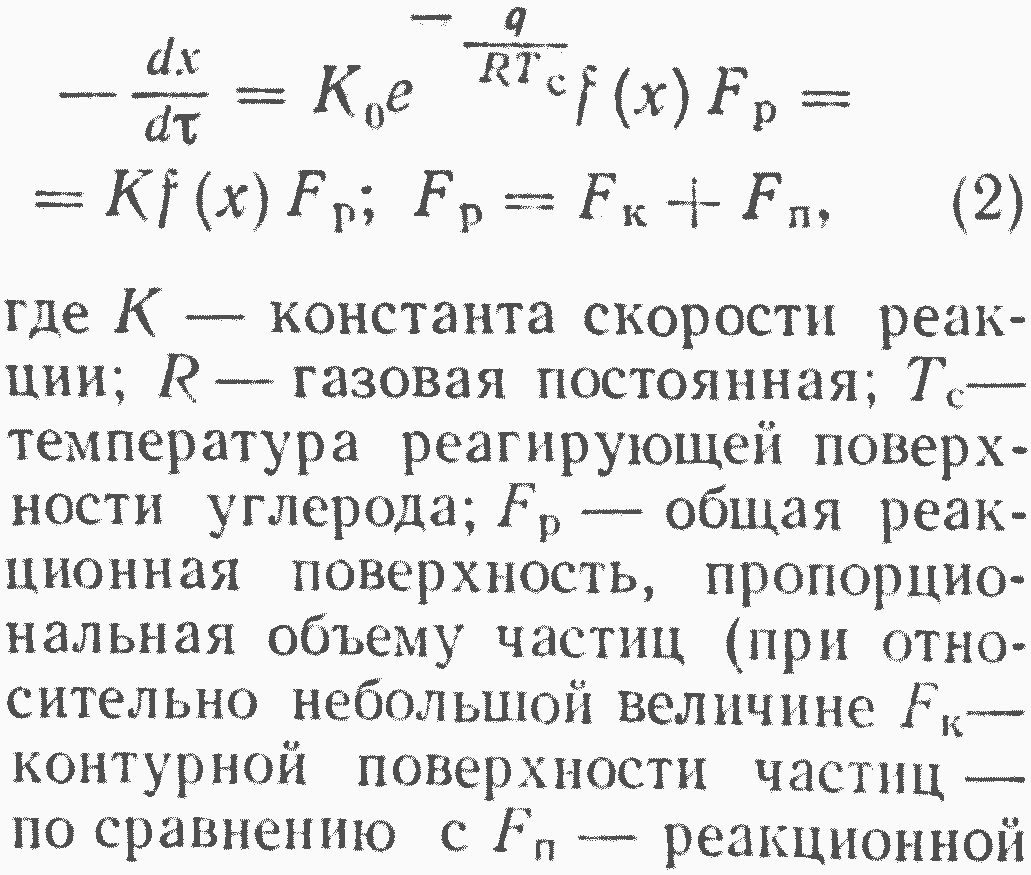
В этой области интенсивность процесса примерно одинаковая во всем объеме частиц, с практически достаточной точностью определяется кинетическим уравнением химической реакции между углеродом и кислородом, которое в общем виде можно записать следующим образом: поверхностью пор); f(x) — функция концентрации кислорода, зависящая от механизма реакции;
энергия активизации гетерогенной реакции.
Область гетерогенного реагирования и, в частности, горения углерода, для которой справедливы уравнения (1) и (2), удобно назвать чисто кинетической областью, так как только в ней можно экспериментально, с практически достаточной точностью, исследовать кинетические
характеристики химических реакций горения углерода и других гетерогенных реакций. В чисто кинетической области интенсивность горения углерода при х и Тс=const пропорциональна весe реагирующего углерода (при Fр ≈ Fп) и не зависит от размера частиц углерода и от гидродинамических условий реагирования углерода с кислородом. Температура реакции в чисто кинетической области сильно влияет на скорость процесса.
Повышение температуры реагирования или увеличение размера углеродной частицы выше некоторого предела приводит к нарушению приближенного равенства, представленного уравнением (1). В этом случае удельная скорость диффузии кислорода в глубину реагирующей частицы оказывается недостаточной для обеспечения реакции при небольшом перепаде концентраций кислорода. В связи с этим концентрация кислорода в центре частицы (хц) начинает практически заметно снижаться.
В результате вместо условий, описанных уравнением (1), создаются условия (рис. 3, б), отвечающие соотношению![]() (3)
(3)
Процесс горения, отвечающий этому соотношению, характеризуется кинетическим режимом на контурной поверхности Fк, но усложнен процессом внутренней диффузии в поры частиц. Здесь экспериментальное исследование кинетики химического процесса в чистом виде невозможно. Область (режим) гетерогенного реагирования, подчиняющегося уравнению (3), можно назвать первой (внутренней) переходной областью.
При достаточно большом размере частиц, различном для разной температуры и сорта углерода кокса, кислород не достигает в практически заметных концентрациях центра углеродной частицы, и хп практически становится равной нулю.
По мере увеличения размера частицы углерода при данной температуре ее поверхности глубина проникновения кислорода внутрь частицы (R—l1) все более уменьшается по сравнению с ее радиусом — размером. При этих условиях (рис. 3, в) уравнение, определяющее скорость взаимодействия углерода с кислородом*, формально будет аналогично уравнению (2) и может быть представлено в следующем виде:
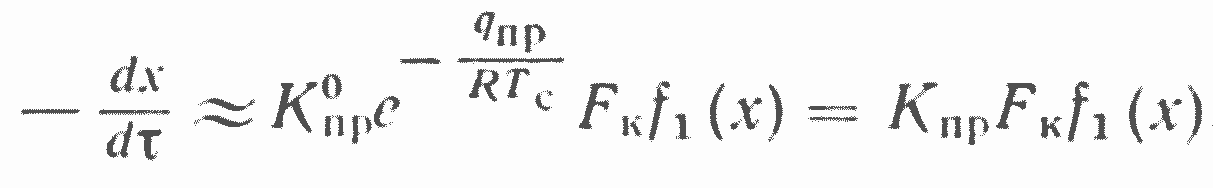 (4)
(4)
где Kпр и qпр — соответственно приведенная константа скорости реагирования и энергия активации; f1(х) — соответствующая функция концентрации реагирующего газа.
Следует отметить, что если f(х) в уравнении (2) дает слабую зависимость (ниже первого порядка) от концентрации кислорода, то f1(х) в уравнении (4) для той же химической реакции будет показывать более сильное, приближающееся к первому порядку, влияние концентрации кислорода на суммарную скорость взаимодействия.
В связи с тем, что уравнение (4) формально аналогично кинетическому уравнению (2), удобно соответствующую уравнению (4) область гетерогенного реагирования назвать кинетической областью, учитывая, конечно, что по существу это лишь псевдокинетическая область.
В этой области при х и Тс, равных const, интенсивность процесса не зависит от гидродинамического режима, но зависит от размера углеродных частиц, так как она приближенно пропорциональна величине внешней, контурной поверхности частиц; температура реакционной поверхности сильно влияет на интенсивность процесса, хотя и в меньшей степени, чем в чисто кинетической и внутренней переходной областях.
Характерной особенностью кинетической области гетерогенного peaгирования является наличие внутреннего реагирования (в порах) при формальной зависимости скорости процесса [см. уравнение (4)], типичной для чисто поверхностных реакций. Эта особенность процесса часто приводит исследователей к неправильному выводу о существовании в этой области гетерогенного реагирования чисто поверхностной реакции. Кинетическая область имеет большое практическое распространение при горении углерода кокса, как мы увидим в дальнейшем, не при основной реакции между углеродом и кислородом, а при реакциях газификации, протекающих между углеродом и водяными парами, а также между углеродом и двуокисью углерода.
Необходимо особо подчеркнуть, что процессы реагирования в чисто кинетической и кинетической областях должны протекать при изотермических условиях по всему реагирующему объему твердой фазы, иначе закономерности процессов будут нарушены.
При дальнейшем повышении температуры реагирования частиц углерода кокса более быстрое увеличение удельной скорости химической реакции, по сравнению с ростом удельной скорости подвода реагирующего газа (кислорода) к реакционной поверхности, приводит к значительному изменению концентрационных напоров, которое начинает постепенно создавать заметную разность между концентрацией кислорода в газовом объеме и на контурной поверхности углеродной частицы. В этих условиях гетерогенный процесс переходит во вторую (внешнюю) переходную область (рис. 3, г), когда х≠хп.
С точностью порядка 10%, представляющей практический интерес, границы второй переходной области определяются следующим уравнением:
![]() (5)
(5)
т. е. концентрация кислорода (или другого реагирующего газа) у внешней контурной поверхности реагирующего кокса уже становится практически заметно меньшей, чем средняя концентрация кислорода в газовом объеме. Абсолютно ясно, что, изменяя температуру реагирования или гидродинамический режим (например, скорость обтекания реагирующей частицы газовым потоком), мы во второй переходной области будем изменять концентрационный напор (х—хп) и, следовательно, изменять интенсивность суммарного реагирования. В этой области скорость горения будет достаточно сильно зависеть как от интенсивности переноса, так и от интенсивности (кинетики) химической реакции между углеродом и кислородом.
Наконец, последняя (пятая) область гетерогенного реагирования и, в частности, горения, которая возникает при еще большем повышении температуры или соответствующем изменении гидродинамического режима реагирования, характеризуется максимальным внешним концентрационным напором (рис. 3, д), когда
![]() (6)
(6)
В диффузионной области горения скорость взаимодействия с кислородом кокса с практически достаточной точностью определяется интенсивностью чисто физического процесса переноса реагирующего газа из газового объема к внешней, контурной поверхности углерода и продуктов реакции от реагирующей поверхности в газовый объем.
Именно по этой причине область, характеризующуюся уравнением (6), практически удобно и целесообразно назвать диффузионной областью. Здесь интенсивность непосредственно гетерогенной реакции практически не зависит от активности реагирующей или активизирующей твердой поверхности. В этом смысле различие сортов углерода кокса (по активности, пористости и т. д.) в диффузионной области не влияет и не может практически заметно (с точностью — 10%) влиять на интенсивность расходования кислорода, и в то же время наиболее сильно влияет изменение гидродинамического режима реагирования (форма поверхности, характер и скорость течения и т. д.).
Из приведенных характеристик различных областей гетерогенного реагирования очевидны практические удобства такого деления, так как, зная, в какой области происходит горение кокса или любая другая гетерогенная реакция, можно заранее предопределить пути ее интенсификации или соответствующей организации*.
Для иллюстрации сказанного рассмотрим несколько примеров. Если нам известно, например, что реакция газификации (CO2 + С) протекает в чисто кинетической области, то можно безошибочно сказать, что в этих условиях измельчение реагирующих пористых 1 коксовых частиц не приведет к интенсификации процесса (на единицу веса коксовых частиц), как не приведет к ней и повышение относительной скорости движения частиц в реагирующем газе. Столь же уверенно можно сказать, что повышение температуры реагирования, как и увеличение эффективной пористости и активности углерода кокса, дадут в этом случае максимально возможное увеличение скорости суммарного процесса.
Теперь представим, что мы установили наличие кинетической области реакции газификации углерода. Тогда можно безошибочно предопределить, что повышение температуры должно будет, хотя и в меньшей степени, чем в чисто кинетической области, ускорять процесс. В отличие от того, что мы имели в чисто кинетической области, размер кусочков кокса будет сильно влиять на скорость реагирования (на единицу веса) углерода. Гидродинамический режим, в том числе и скорость потока газа, в этом случае, как и в чисто кинетической и в первой переходной областях, не будет влиять на суммарную скорость реагирования.
Если известно, что реакция происходит в диффузионной области, то одной из характерных особенностей этого процесса будет относительно слабая зависимость его интенсивности от температуры реагирования. Здесь особенно сильное влияние на интенсивность горения и всякого другого аналогичного гетерогенного процесса оказывает размер твердых частиц. Это связано с тем, что изменение размера, например, углеродных частиц не только резко изменяет внешнюю, контурную поверхность, которая одна и является в диффузионной области реакционной**, но также изменяет и интенсивность переноса реагирующих молекул газа к контурной поверхности.
При одновременности нескольких гетерогенных реакций на твердой поверхности, как это и наблюдается при горении углерода кокса, различные реакции могут протекать в определенных условиях в различных областях (режимах) гетерогенного реагирования, и поэтому, если мы знаем, в какой области каждая реакция происходит, то мы получаем возможность управлять выходом продуктов этих реакций, изменяя условия, которые интенсифицируют одну из реакций и практически не влияют на интенсивность другой.
1 При Fп значительно большем Fк
Для использования всех преимуществ, которые дает разделение гетерогенного реагирования на пять характерных областей (режимов), необходимо уметь с достаточной точностью рассчитывать их границы для конкретных гетерогенных реакций и интересующих нас условий.
При анализе гетерогенного горения, так же как и большинства других экзо- и эндотермических реакций, следует всегда учитывать тот факт, что эти реакции в обычных условиях теоретически не могут быть изотермическими. Из этого бесспорного положения вытекает четвертый основной закон горения, который может быть сформулирован в следующем виде.
Горение углерода кокса теоретически всегда протекает в неизотермических условиях; количественная оценка неизотермичности горения определяется конкретными условиями реагирования углерода с кислородом и протекания вторичных реакции.
При исследовании процессов горения и газификации и при разработке систем их расчета и технического осуществления необходимо обязательно учитывать все четыре основных закона горения углерода кокса.

