Изучению реакции восстановления двуокиси углерода углеродом посвящено много десятков, если не сотен, работ. Интерес к этой реакции вполне понятен потому, что в большинстве промышленных печей окись углерода, являющаяся активным или целевым продуктом, образуется в результате протекания реакции восстановления двуокиси углерода.
Реакция восстановления CO2 обратима, но уже для 850° скорость обратной реакции примерно в 100 раз меньше прямой. Для температур выше 850 обратную реакцию при кинетических и тепловых расчетах для большинства промышленных аппаратов можно не учитывать, так как ее скорость относительно невелика. При более низких температурах скорости как прямой так и обратной реакций чрезвычайно низкие и в газообразовании и в обычных достаточно интенсивных процессах горения эти реакции заметного участия также не принимают.
Одной из наиболее ранних достаточно капитальных работ, посвященных изучению скорости реакции восстановления двуокиси углерода, является давно опубликованная работа Клемента, Адамса и Хаскинса [29]. Авторы изучали по количеству образующейся окиси углерода влияние температуры (в пределах 700—1300°) и времени реагирования (в пределах 1,5—190 сек.) на восстановление двуокиси углерода коксом, древесным углем и антрацитом. Двуокись углерода пропускалась через слой топливных частиц размером — 5 мм, находящихся в фарфоровой трубке, обогреваемой электрической печью.
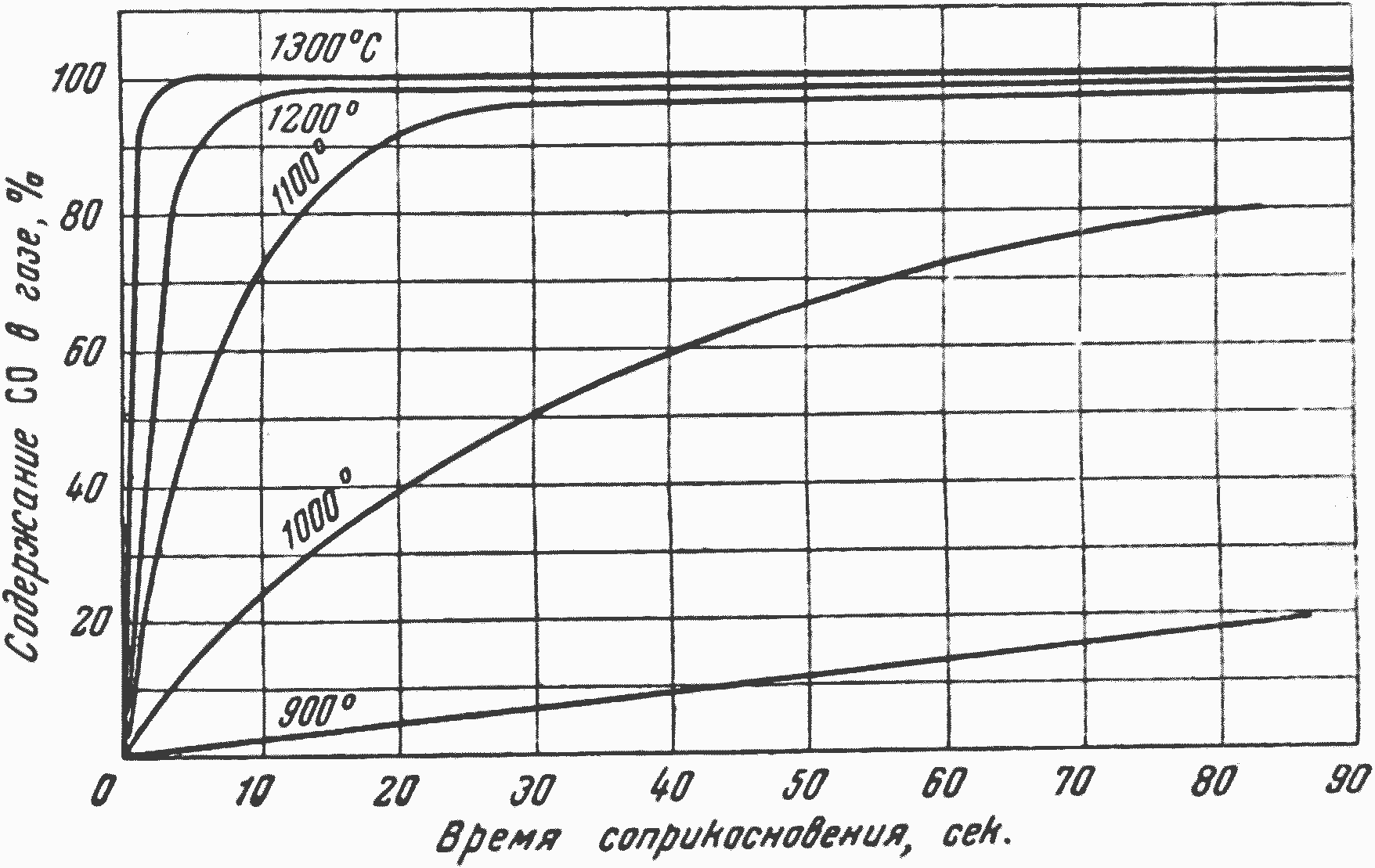
Рис. 13. Влияние времени реагирования на степень восстановления двуокиси углерода при различных температурах (по данным Клемента, Адамса и Хаскинса)
На рис. 13 представлено изменение концентрации СО, получаемого в газе в результате реагирования кокса с двуокисью углерода, при увеличении времени нахождения газа в контакте с коксом, при различных температурах.
На рис. 14 в аналогичных координатах дано сравнение интенсивности разложения двуокиси углерода (при 1100°) на трех видах топлива.
В дальнейшем аналогичных исследований реакции CO2 + С было выполнено весьма много, причем результаты их в ряде случаев имели резко противоречивый характер. В большинстве исследований обнаруживалась экспериментальная зависимость скорости реакции от скорости газового потока, содержащего CO2 и продукт реакции — окись углерода. Этот результат обычно истолковывается как следствие влияния диффузионного торможения на интенсивность реакции CO2 + С.
В 1934 г. Майерс [30] для исключения влияния диффузионного фактора увеличивал скорость реагирующего газа до тех пор, пока она переставала влиять на выход реакции*. Постоянство выхода он считал доказательством равенства концентрации CO2 в газовом объеме и на реакционной поверхности, т. е. условием, обеспечивающим получение кинетических характеристик реакции.
Однако очевидно, что это условие, вытекающее из первого сформулированного выше закона горения (гетерогенного реагирования), не гарантировало получения истинных кинетических характеристик, так как необходимо было учесть также и второй сформулированный нами закон горения и исключить искажения, связанные с влиянием диффузии реагирующего газа к внутренней реакционной поверхности углерода и реагированием этой поверхности. Дополнительным важным и практически трудно осуществимым условием получения экспериментальных данных является также изотермичность всей реагирующей поверхности. Выполнение этого условия значительно усложняется реагированием в объеме твердой фазы на поверхности пор. Длительное время считалось, что гетерогенные реакции С+O2 и CO2+С протекают только на внешней контурной поверхности углерода и поэтому внутреннее реагирование не учитывалось.

Рис. 14. Восстановление двуокиси углерода древесным углем (7), коксом (2) и антрацитом (3) при температуре 1100° С (по данным Клемента, Адамса и Хаскинса)
Открытие внутреннего реагирования углерода [9], [5] показало, что это положение было
неправильным. Как уже отмечалась, многочисленные исследования [11], [12], [13] убедительно подтвердили большое значение внутреннего реагирования, особенно для сравнительно медленных гетерогенных реакций типа CO2+С. Исследования Майерса [10] опубликованные в 1939 г., полностью подтвердили вывод Чуханова о большом значении внутреннего реагирования углерода с газами и, в частности, с двуокисью углерода.
Вторым бесспорным и общепринятым положением (наряду с реагированием углерода только на внешней поверхности) при нормальном давлении длительное время считался первый порядок гетерогенных реакций горения углерода и восстановления двуокиси углерода. В 1932—1933 гг. автор, изучая процесс окисления аэровзвеси древесного угля, показал [91, 15], что взаимодействие углерода с кислородом при обычных условиях может иметь порядок реакции по кислороду, изменяющийся от нулевого до первого. В 1939 г. в работе Альтшулера и Чуханова [13] значительные отклонения от первого порядка были обнаружены при атмосферном давлении и для реакций CO2+С. Примерно в тот же период Мейером были проведены исследования реакции восстановления двуокиси углерода на графитовой нити в высоком вакууме, которые показали, что реакция CO2+С в вакууме порядок и высокую энергию активации, превышающую 90 000 ккал/моль.
Дальнейшие экспериментальные исследования этой, на первый взгляд весьма простой реакции, привели к новым, еще более неожиданным результатам. Примерно одновременно при проведении работ было обнаружено исключительно сильное влияние примеси окиси углерода на кинетические характеристики реакции CO2+С. Указания на возможность влияния СО на кинетику реакции между углеродом и CO2 имелись также в работах Д. А. Франк-Каменецкого и сотрудников Хиншельвуда. Теоретический анализ влияния СО на кинетику реакции CO2+С был дан в 1949 г. З. Ф. Чухановым на основе развитой им теории восстановления двуокиси углерода.
Наиболее интересным и практически важным явлением, обнаруженным Н. А. Каржавиной в 1950 г., была несомненная и непосредственная количественная взаимосвязь между реакциями CO2+С и H2О С. Оказалось, что при совместном протекании реакции восстановления CO2+H2О углеродом суммарная скорость газификации углерода, т. е. перехода углерода в газ, была при достаточно высоких концентрациях CO2 и H2О (свыше 10—15%) такой же, как и при отдельном реагировании двуокиси углерода или водяных паров с углеродом. Это явление имеет несомненную связь с резким различием интенсивности реакции восстановления CO2, обнаруженным еще в работах Беккера 1381 в так называемой сухой среде.
Таким образом, приведенные нами краткие данные свидетельствуют, что эта, на первый взгляд сравнительно простая, реакция является в действительности сложным гетерогенным процессом.
Образовавшийся поверхностный комплекс, кроме обратного распада, может, очевидно, разлагаться и с образованием окиси углерода. Экспериментальные исследования показывают, что этот распад может идти как по нулевому порядку по CO2 (термическое разложение), т. е. без участия удара молекул CO2 из газа, так и по первому порядку, с активным реагированием комплекса с молекулами СОз, ударяющимися о поверхность углерода, вернее, о поверхность комплекса СХОУ.
Исходя из этих соображений, третий этап реагирования можно записать как параллельное протекание двух реакций [391:
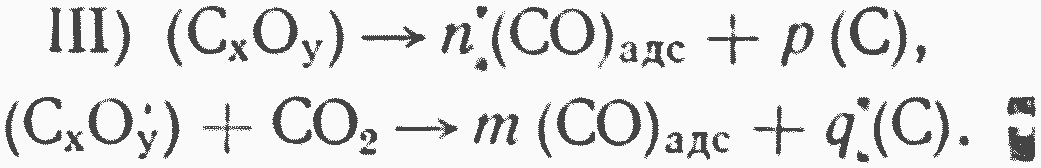
Совершенно очевидно, что четвертым этапом реагирования будет обратимый процесс десорбции окиси углерода с поверхности
![]()
Для того, чтобы получить ясное представление о характерных особенностях реакции CO2 + С при различных условиях, рассмотрим физико- химический механизм ее в таком виде, как его можно представить на основании имеющихся экспериментальных данных.
Все или почти все исследователи приходят к выводу о том, что реакция восстановления двуокиси углерода идет через процесс адсорбции и образование твердого поверхностного комплекса типа СХОУ. Отсюда первые два этапа реагирования можно представить в следующем виде:
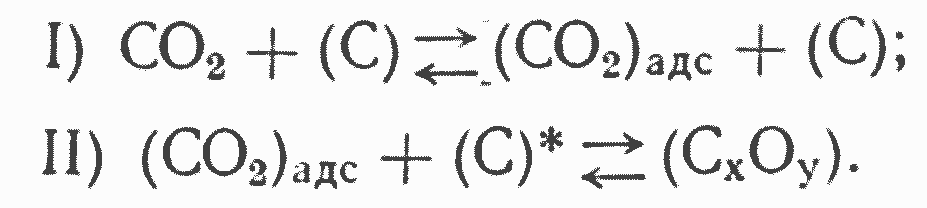
Как показывают исследования Л. Мейера, адсорбционный процесс образования мономолекулярного слоя не может в обычных условиях лимитировать интенсивность процесса восстановления двуокиси углерода. В условиях высокого вакуума, по данным опытов Л. Мейера, реагирование CO2 идет преимущественно через первую реакцию третьего этапа, так как в силу малого давления CO2 в газе число соударений молекул CO2 с комплексом СХОУ незначительно и скорость второй реакции третьего этапа относительно невелика. При указанной схеме реагирования суммарный порядок реакции CO2 + С в вакууме должен быть нулевым, что и наблюдало большинство исследователей.
Если третий этап реагирования является лимитирующим и идет через вторую реакцию, то реакция будет иметь макрокинетическии суммарный первый порядок по CO2.
Адсорбция окиси углерода по уравнению четвертого этапа выключает часть поверхности углерода из реакции, так как на этой поверхности уже не образуется комплекс СХОУ. Рассмотрим изотермическое реагирование CO2 с углеродом в чисто кинетической области реагирования, где молярные концентрации CO2 (х) и СО у) и в газовом объеме и на всей реакционной поверхности углерода Sр одинаковы.
Реакционная поверхность Sр распределится между адсорбционно активными газами, занимающими одни и те же активные участки углерода. При этом реакционная поверхность, занимаемая адсорбированной двуокисью углерода, включает также хемосорбированную CO2 в виде комплекса СХОУ, могущего вести к образованию газообразной окиси углерода.
В случае, когда вся реакционная поверхность занята CO2, СО и СХОУ и другие активные адсорбируемые газы отсутствуют, можно определить долю поверхности, занятой CO2 и СХОУ — S(CO2, СХОУ), из уравнения

Уравнение (33) составлено без учета изменения концентрации за счет разбавления, связанного с изменением реагирующих продуктов вследствие образования из одной молекулы CO2 двух молекул СО. Изменение объема реагирующего газа можно определить из баланса кислорода в газе и из баланса инертных примесей

Уравнение (38) дает распределение концентрации CO2 по слою угля как при реагировании чистой углекислоты, так и разбавленной окисью углерода (у0) или инертными примесями типа азота1.
1При расчетах для кинетической области удобнее использовать размерность S (кг/м3 слоя), так как Sp пропорциональна весу углерода.

в то время как кривая (1) [по уравнению (41)] показывает резкое замедление расхода CO2 по высоте слоя. Объясняется это тем, что по мере расходования CO2 увеличивается концентрация окиси углерода, отравляющей реакционную поверхность углерода.
Характер полученных кривых (41), соответствующих действительному механизму реакции, достаточно хорошо объясняет, почему в условиях практической работы газогенераторов восстановление последних долей CO2 идет крайне медленно, так что даже при самых благоприятных условиях в газе остается почти всегда сравнительно высокая концентрация CO2. Только при относительно весьма высокой температуре практически удается ее значительно снизить.

Из рис. 15 видно, что для еще значительной остаточной концентрации CO2, равной 10% исходной, необходимая высота слоя топлива1 вследствие отравляющего действия адсорбции СО увеличивается примерно в три раза.
Для определения зависимости расходования CO2 от высоты слоя для различных начальных концентраций CO2 (при разбавлении Ν2 и СО) воспользуемся уравнением (39).
На рис. 16 представлены полученные кривые изменения величины (х0—х) по высоте слоя для Кр=1,0, К0=0,2, К2/Κ1=1 и А=1,0 и для различных начальных концентраций CO2. Как видно, реагирование CO2 весьма резко (особенно для малых х0) тормозится примесью окиси углерода, так что зона реагирования растягивается во много раз при разбавлении CO2 (до 20%) не азотом, а окисью углерода.
Как видно из рис. 17, а, на котором представлено изменение (х0—х) с ростом начальной концентрации CO2 в газовой смеси, характер зависимости при разбавлении CO2 окисью углерода резко изменяется. Результаты экспериментальных исследований Льюиса и Каржавиной 1321, представленные на рис. 17, б, в, свидетельствуют об аналогичной зависимости.

Представленный химический механизм процесса восстановления двуокиси углерода удовлетворительно объясняет большинство достоверных экспериментальных данных.
Прежде чем использовать экспериментальные данные для разработки системы расчета реагирования CO2 с углеродом, рассмотрим те требования, которым они должны удовлетворять для того, чтобы считаться достоверными, отвечающими определенным условиям протекания реакции. Мы хорошо знаем, как трудно при исследовании горения углерода создать изотермический режим в связи с сильной экзотермикой этой реакции. Реакция восстановления СОз эндотермична, и в связи с этим считалось, что обеспечить для ее изучения изотермический, достаточно точно фиксируемый режим реагирования нетрудно путем подогрева углерода и реагирующего газа в электрической печи. Однако такое предположение привело многих исследователей к серьезным ошибкам, а полученные ими экспериментальные данные в связи с этим нельзя считать достоверными и, во всяком случае, точными, так как опыты практически проводились при неизвестном и, как правило, переменном температурном режиме реагирования.
Восстановление CO2 есть сильно эндотермическая реакция и, в соответствии с четвертым законом горения углерода — кокса, ее полное завершение при реагировании газа, содержащего 30% двуокиси углерода (с малозольным углеродом кокса), вызывает в адиабатических условиях охлаждение реагирующей системы более, чем на 1100°. При анализе теплового режима восстановительной зоны горящего слоя, канала или газовой взвеси мы увидим, что эндотермика реакции СОз + С — одна из причин, по которой эта реакция в восстановительной зоне почти никогда не может в современных промышленных аппаратах находиться в диффузионной области.
Таким образом, первой и пожалуй самой основной трудностью экспериментальных исследований реакции CO2+С является трудность поддержания заданного температурного режима реагирования на всей реакционной поверхности. Если исследование этой реакции ведется на отдельной реагирующей частице крупных размеров, то при сколько-нибудь заметной скорости разложения CO2 температура углеродной частицы неодинакова по радиусу частицы. Частица, нагреваемая с поверхности газовым потоком или излучением электропечи, реагирует — в чисто кинетической, кинетической и переходных областях — в основном в глубине коксовых частиц, где углеродная масса быстрее охлаждается за счет эндотермики реакции. Медленный подвод тепла в связи с низкой теплопроводностью частицы часто не компенсирует расхода тепла на реакцию, и в углеродной частице температура значительно уменьшается к центру.
При изучении реакции CO2+С в углеродном канале или в слое углеродных частиц, кроме изменения температуры по толщине углеродной стенки или по радиусу частиц, происходит сильное снижение температуры газа и углеродной поверхности по ходу газового потока за счет расходования физического тепла газа на эндотермику реакции. Подвод тепла от стенок реакционной трубки не может, как правило, синхронно компенсировать этих тепловых потерь, так как тепло подводится обычно не в соответствии с его расходованием в каждой точке реакционного пространства. В этом случае создается неизотермичность реагирования как по радиусу частиц (для канала — по толщине углеродной стенки), так и по длине слоя или канала. Естественно, что в этих условиях неизотермичным оказывается и газовый поток.
Изучение реакции восстановления более выгодно (с точки зрения теплового режима) осуществлять в так называемом кипящем (псевдосжиженном) слое, где температура по высоте слоя выравнивается за счет материального обмена — перемешивания углеродных частиц при их интенсивном движении в слое. Однако и в этом случае неизотермичность по углеродной (коксовой) частице и основная неизотермичность (газ — поверхность) остаются, если не применять при этом весьма мелких частиц кокса. Таким образом, экспериментальные данные, полученные при исследовании кинетики реакции CO2+С без принятия специальных мер по обеспечению заданного температурного режима, не являются, как правило, надежными и достоверными.
Вторая серьезная трудность экспериментального исследования реакции CO2+С связана с обнаруженным Цухановой изменением активности поверхности углерода кокса при реагировании двуокиси углерода.
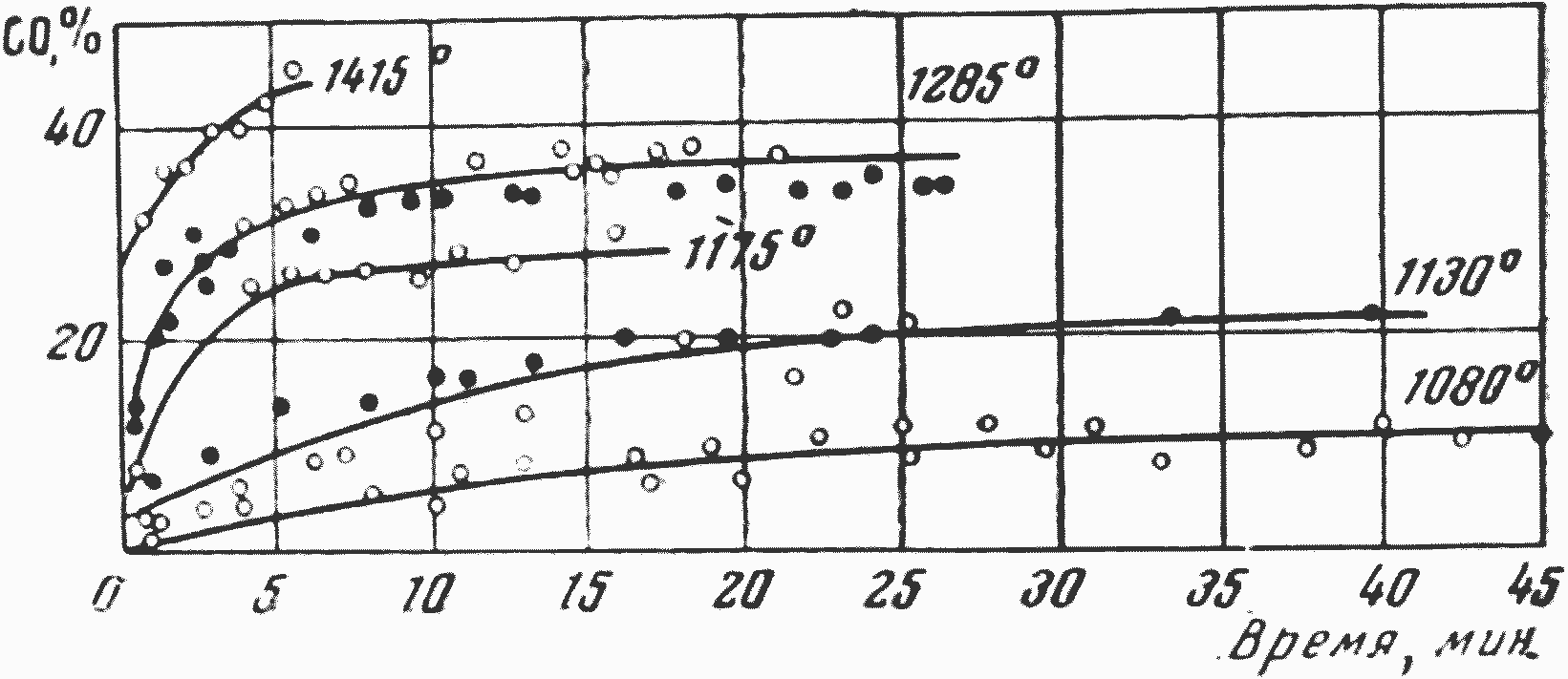
Рис. 18. Кривые изменения интенсивности реагирования CO2 (в углеродном канале) во времени (по данным О. А. Цухановой)
Кривые изменения интенсивности реагирования CO2 (в углеродном канале) во времени, полученные Цухановой, приведены на рис. 18. Как видно из рисунка, при прочих постоянных условиях интенсивность реагирования CO2 изменяется, увеличиваясь со временем за счет разработки поверхности, т. е. за счет увеличения размера внутренней реакционной поверхности углерода. Если экспериментальные исследования скорости реакции CO2 + С проводятся без учета фактора стабилизации величины и активности реакционной поверхности углерода, то они также количественно недостоверны или, во всяком случае, весьма неточны.
Наконец, существенным фактором, обеспечивающим возможность использования экспериментальных данных для получения кинетических и др. характеристик реакции CO2 + С, является изучение процесса при небольшом изменении реагирующей концентрации двуокиси углерода. Это условие, способствующее выполнению исследования при изотермическом режиме, важно и потому, что сложность процесса взаимодействия CO2 с углеродом затрудняет все подсчеты и определения характерных величин при сильном изменении концентрации CO2 и СО, особенно (как видно из рис. 15) при сравнительно небольших остаточных концентрациях двуокиси углерода.
Если учесть все указанные условия, обеспечивающие достоверные и достаточно высококачественные экспериментальные данные по интенсивности реагирования углерода с CO2, то из многочисленных исследований реакции CO2 + С оказывается возможным использовать только весьма ограниченный материал. Первым и достаточно высококачественным является исследование Цухановой 121] восстановления двуокиси углерода в канале из электродного угля, проведенное в интервале температур от 800 до 1400° при изменении концентрации CO2 от 8 до 97% и скорости газового потока от 1 до 13 м/сек. Диаметр углеродного канала составлял 7 мм, а длина 370 мм. В связи с тем, что канал обогревался путем непосредственного пропускания электрического тока через электродный уголь, удалось при сравнительно небольшой суммарной скорости реагирования обеспечить удовлетворительные результаты по температурному режиму.
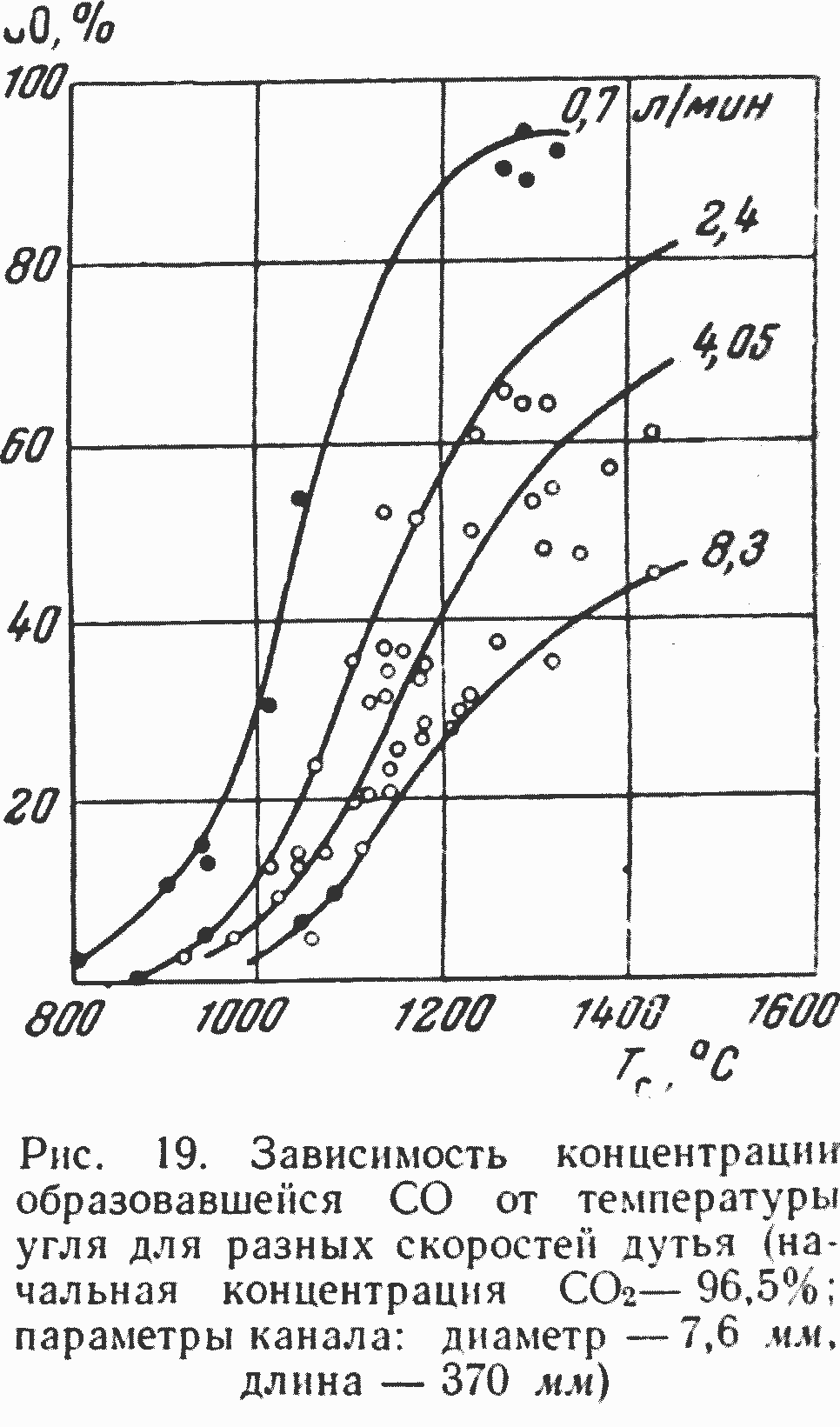
Недостатком работы является то, что исследования были проведены при сравнительно невысоких температурах и с каналом только одной длины и диаметра, что привело к значительному изменению концентрации CO2 при высоких температурах и не позволило построить экспериментальных кривых изменения концентрации двуокиси и окиси углерода по длине канала.
На рис. 19 приведены экспериментальные данные, полученные Цухановой при различных температурах и расходах двуокиси углерода.
По такой же методике была выполнена работа Вулиса и Витмана по восстановлению CO2 в углеродном канале.
На рис. 20 приведен график, взятый из этой работы и изображающий зависимость скорости реакции CO2+С от Re, т. е. в данном случае (d-const) от скорости подачи двуокиси углерода в канал. Как мы покажем ниже, в пределах температур, представленных на графике, реакция CO2+С на электродном угле в канале находится в кинетической области и удельная скорость ее не может изменяться при изменении скорости подачи газа. Экспериментальные материалы Вулиса по реакции CO2+С являются неточными. Влияние скорости газа на скорость реакции, как и в работе Майерса [10], связано, вероятно, с различной степенью расходования CO2, неизотермичностью реагирования и тормозящим действием окиси углерода на реакцию. Более полные экспериментальные исследования реакции восстановления CO2 углеродом были выполнены Каржавиной [32] в коротком слое углеродных частиц высотой в несколько миллиметр в (обычно не более 5—10 мм). Опыт проводился быстро и заканчивался меньше, чем за 1 мин. Выбранная методика и тщательное выполнение опытов позволили получить большое количество достаточно точных и в значительной части достоверных экспериментальных данных, по которым можно проанализировать особенности и кинетические характеристики реакций на электродном угле, антраците и древесном угле. Эти исследования также, к сожалению, проведены при сравнительно низких температурах, всего до 1300°.
Первым вопросом, который необходимо было решить при исследовании, обеспечивавшем все основные условия экспериментального изучения реакции CO2+С, являлся вопрос о влиянии скорости газового потока на скорость реакции в наиболее интересной области температур.
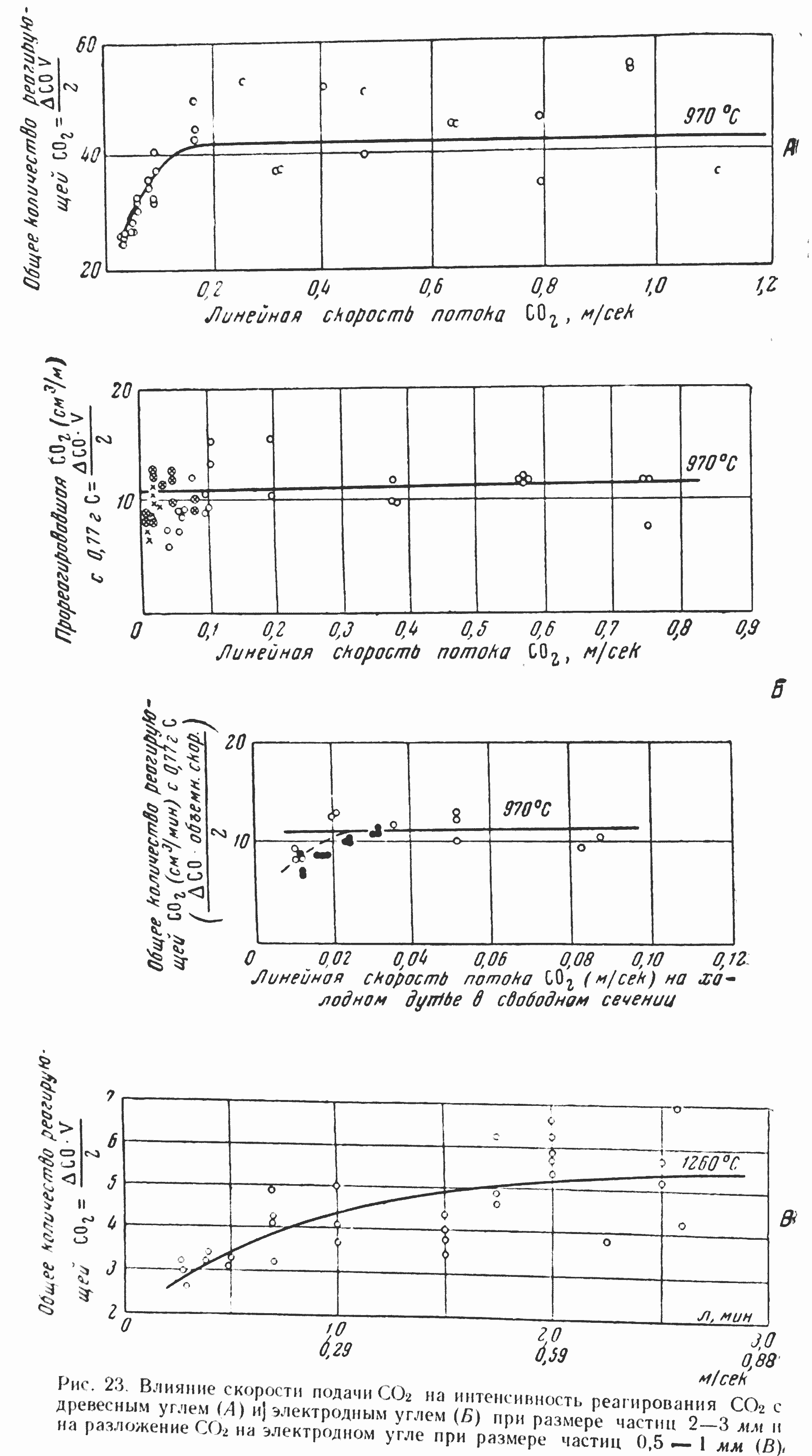
Кроме отмеченной выше работы Вулиса, во многих работах, в том числе [13], [30] и др., было обнаружено, как показывают рис. 20, 21 и 22, сильное влияние скорости газа на удельную скорость реакции CO2+С.
На рис. 21 представлена зависимость удельной скорости реакции CO2+С от скорости газового потока, полученная В. С. Альтшулером для древесного и электродного углей при температуре 900—1050°.
На рис. 22 приведено, по данным Майерса, изменение концентрации окиси углерода в получаемом газе при увеличении скорости газового потока.
Концентрация СО должна в этих опытах уменьшаться с увеличением скорости газа, если удельная скорость реакции CO2 + С не зависит от скорости газового потока.

Рис. 20. Зависимость скорости реакции CO2+С в углеродном канале от числа Re (по данным Л. А. Вулиса и Л. А. Витмана [40])
Параметры канала: диаметр — 4 мм, длина — 90 мм

Рис. 21. Влияние скорости газового потока на интенсивность восстановления CO2 древесным углем (А) и электродным углем (Б) (по данным В. Альтшулера)
Характер кривых рис. 22 показывает, что в опытах Майерса, как и в опытах Альтшулера, скорость газового потока сильно влияла на удельную скорость реакции. Влияние скорости газа было обнаружено даже при температурах 900 и 1000 С, когда теоретически этого влияния как гидродинамического фактора, безусловно, не должно и не могло быть.
В опытах Каржавиной кратковременность их проведения обеспечивала за счет аккумуляции тепла некоторую устойчивость температурного режима и стационарность реакционной поверхности, а малые изменения (— 5—10%) начальной концентрации CO2 и малая продолжительность большинства опытов способствовали сохранению близкого к изотермическому режиму реагирования и исключали искажения, связанные с сильным влиянием адсорбции окиси углерода. Поэтому здесь можно было ожидать, как мы уже отмечали, получения достоверных результатов, необходимых, в частности, для решения важного вопроса о влиянии скорости потока газа CO2 на скорость реагирования. Опыты (различные серии и в различных реакционных трубках), проведенные при 900, 1000 и даже 1300, однозначно показали, как видно из рис. 23, отсутствие сколько- нибудь существенного влияния скоростного (гидродинамического) фактора на удельную скорость реакции CO2+С как на древесном, так и на электродном углях.

Рис. 22. Влияние скорости газового потока на величину, пропорциональную концентрации окиси углерода (по данным Мейерса)
Небольшое влияние скорости газа, которое можно обнаружить при весьма малых значениях скорости CO2 или при высокой температуре, связано с повышенной концентрацией окиси углерода, образующейся при опыте в этих условиях. Таким образом, как и следовало ожидать, в исследованных областях изменения температуры реакция восстановления CO2 углеродом не только не протекает в диффузионной области, но в значительной степени не попадает и во вторую переходную область гетерогенного реагирования., Анализ экспериментальных данных Цухановой [21] полностью подтверждает этот важный вывод.
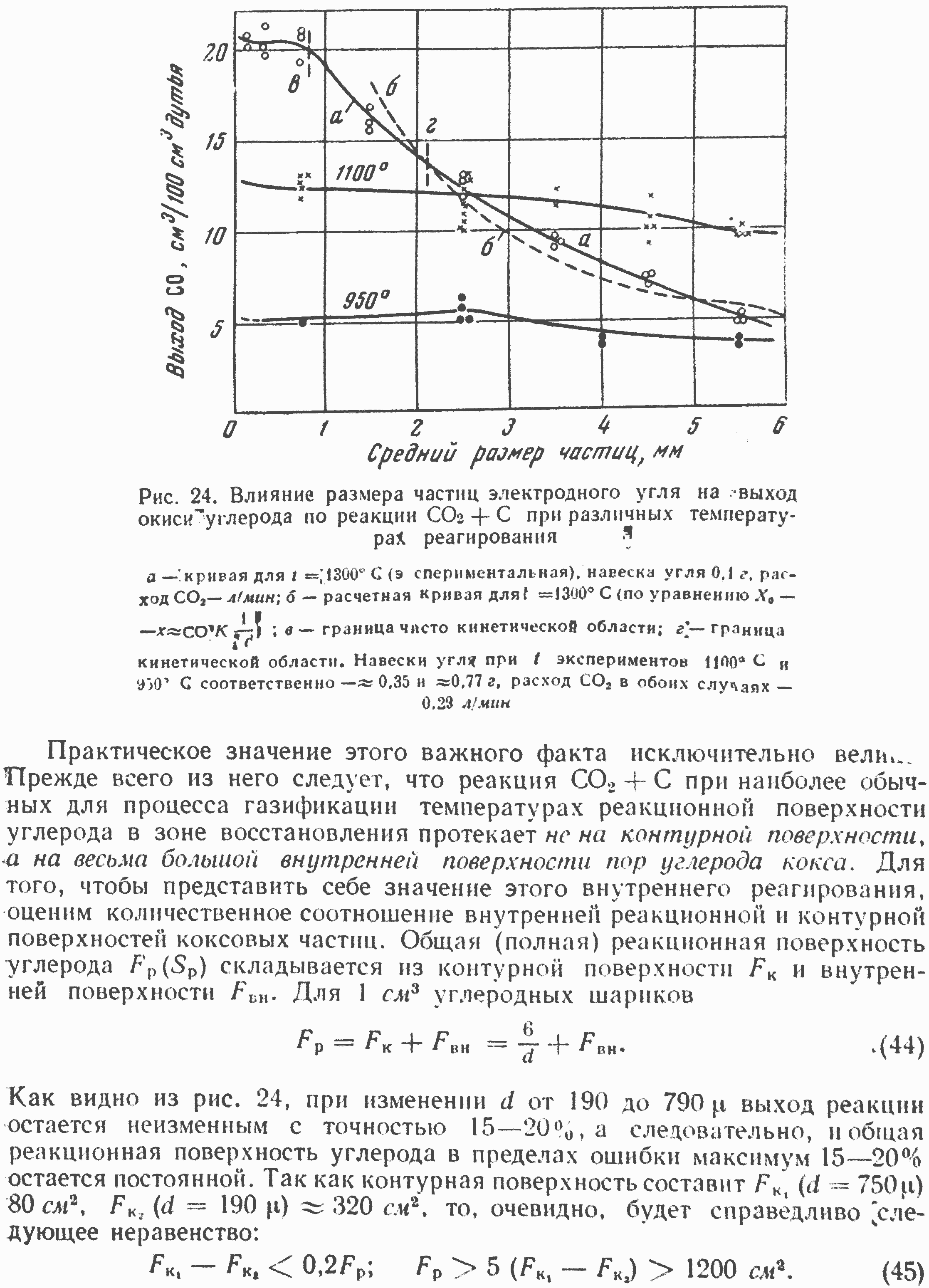
При анализе условий, определяющих переход гетерогенного процесса горения углерода из чисто кинетической в первую переходную и затем в кинетическую области, мы отмечали важное значение экспериментальных исследований влияния размера углеродных частиц (см. рис. 5) на интенсивность реагирования CO2 с углеродом. Эти исследования позволяют определить, в какой области находится данная гетерогенная реакция и в соответствии с этим установить возможность получения истинных макрокинетических характеристик реакции.
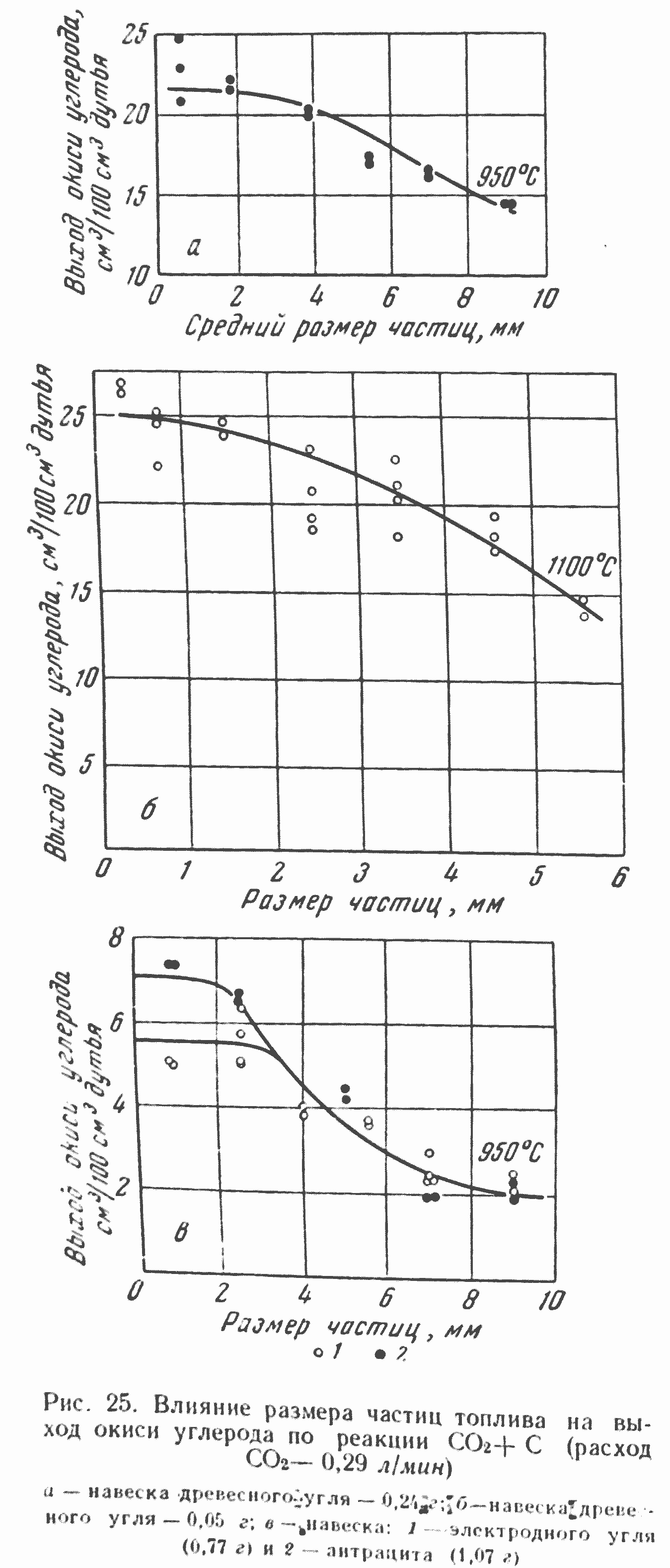
На рис. 24 и 25 приведены экспериментальные данные, показывающие влияние размера частиц электродного угля и древесного угля на выход реакции восстановления двуокиси углерода*, т. е. на количество окиси углерода, образующейся в единицу времени при реагировании с заданной навеской углерода кокса. Полученная зависимость имеет весьма характерный вид, аналогичный теоретической кривой, представленной выше на рис. 5. При малых размерах частиц изменение их величины практически совершенно не влияет на выход реакции, что характеризует наличие в этих условиях чисто кинетической области гетерогенного реагирования. Далее, при количественном определении границ различных областей реагирования CO2, мы более подробно рассмотрим кривые рис. 24.
Сейчас же подчеркнем один исключительно интересный факт. Как уже отмечалось, при 1300 реакция взаимодействия углерода электродного угля с двуокисью углерода как в углеродном канале, так и особенно в слое мелких частиц углерода, через который продувается реагирующий газ, находится практически целиком в кинетической области (а также в первой переходной или в чисто кинетической), даже при незначительных скоростях газового потока. Рис. 24 показывает, в подтверждение этого важного вывода, что для размера частиц электродного угля до 0,7—0,8 мм реакция CO2+С при 1300 находится в чисто кинетической области, где возможно исследование ее истинных кинетических характеристик и где гидродинамический режим вообще не может иметь какого-либо влияния на удельную скорость реагирования.
Таким образом, истинная реакционная поверхность частиц электродного угля даже размером в 200 μ по крайней мере в 4 раза больше внешней контурной поверхности. Сферическая частица электродного угля объемом в 1 см3 (d ~ 1 25 см) при Fк=5 см обладает общей реакционной поверхностью свыше 1200 см2, превышающей контурную (геометрическую) поверхность частицы более чем в 240 раз. По данным исследовании М. В. Королевой [41], удельная общая поверхность, определенная по низкотемпературным изотермам адсорбции, в 250—2000 раз превышает гео метрическую (контурную) поверхность кокса, полученного из различных углей. Таким образом, порядок величин Fp близкий, хотя следует учесть, что не вся поверхность пор, замеряемая методом адсорбции, является реакционной вследствие трудной доступности части поверхности микропор для реагирующего газа. Как мы отмечали, по косвенным ориентировочным определениям Хитрина [21], величина Fвн для электродного угля составляет—140 см2/см3 и изменяется для различных сортов электродного угля в достаточно широких пределах, достигая 500 см2/см3.
Приведенные результаты определения Fвн показывают, что полученное нами неравенство (45), по-видимому, хорошо отражает фактическое положение, но является несколько заниженным, так как опыты с более мелкой (меньше 190 μ) фракцией электродного угля, которые могли бы уточнить величину Fp, не проводились.
Различные партии электродного угля имеют различные Fр.
При реагировании CO2 с углеродом величина реагирующей внутренней поверхности зависит от глубины реагирования CO2 в углеродной массе. В дальнейшем мы рассмотрим условия, определяющие эту глубину проникновения CO2 и следствия, вытекающие из внутреннего реагирования и связанные с ним. Здесь нам хотелось лишь подчеркнуть, что даже проникновение реакции лишь на глубину 0,5—1,0 мм приводит к 50—100-кратному увеличению реагирующей поверхности Это на первый взгляд несколько неожиданное положение, как правило, не учитывалось и не учитывается многими исследователями. Для примера можно привести следующее заключение из работы Вулиса [40]:
«Специальные исследования, проведенные в связи с известной работой Майерса [10] на каналах с разной толщиной стенок (от 2,5 до 8 мм), показали, что для условий экспepимента реакция с практической точностью локализуется на геометрической поверхности угля» (разрядка наша.— З. Ч.).
Очевидно, что проникновение реакции CO2 + С в опытах Вулиса лишь на 2,5 мм в глубину стенок канала изменяло бы реакционную поверхность в сотни раз и приводило бы к резкому изменению получаемых закономерностей процесса.
Среди кинетических характеристик, определяющихся закономерностью реагирования CO2 с углеродом, весьма существенное значение имеет порядок реакции по CO2. Из теоретического уравнения Чуханова [39], определяющего скорость взаимодействия CO2 с углеродом, очевидно, что макрокинетический замеряемый порядок этой реакции по CO2 весьма слежен и может изменяться в пределах от нулевого до первого, а с учетом тормозящего действия окиси углерода — и выше первого.
Широко распространенное мнение о том, что реакция CO2+С, как и С+О2, имеет первый порядок, объясняется не столько наличием фактического достоверного материала, сколько желанием исследователей иметь первый порядок реакции в связи с получающейся при этом простотой теоретического анализа и создания расчетной системы. Принятие первого порядка реакции восстановления двуокиси углерода заманчиво во многих отношениях: оно позволяет упростить не только расчет интенсивности процесса образования окиси углерода, но и расчет теплового режима процесса, а также анализ газообразования при совместном протекании нескольких реакций. Однако сначала необходимо доказать правомерность и возможность, хотя бы в первом приближении, использования в расчетах первого порядка для оценки влияния CO2 на суммарную скорость реакции CO2+С.
Экспериментальные данные, полученные Каржавиной [32], Льюисом [33] и др., по влиянию концентрации двуокиси углерода на интенсивность процесса в изотермических условиях в чисто кинетической области убедительно подтверждают изложенную выше теорию реакции СОз 4- С, из которой, к сожалению, следует не первый, а переменный макрокинетический (видимый) порядок этой сложной реакции.
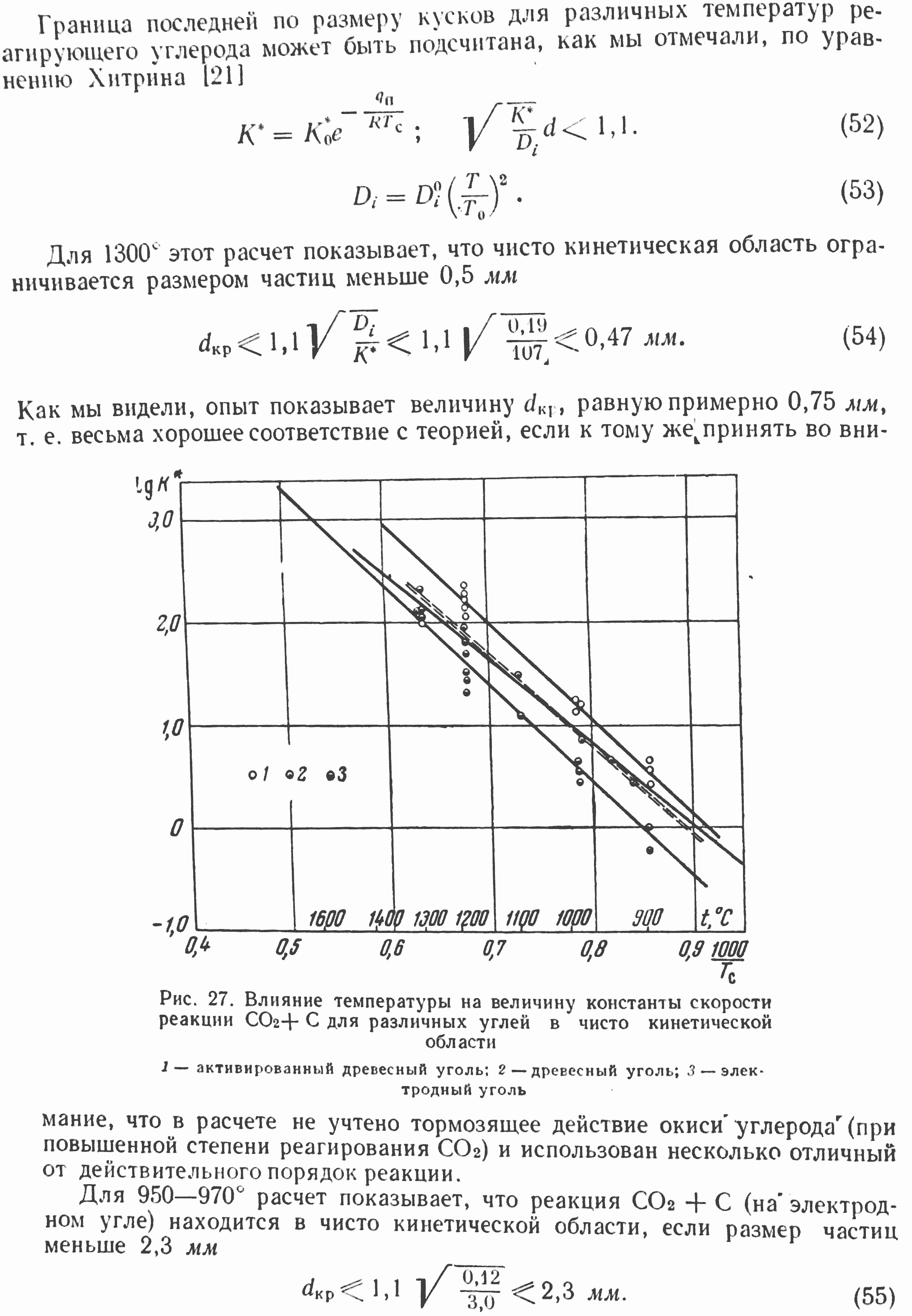
На рис. 26, а показано влияние концентрации CO2 на выход реакции CO2+С при различных температурах разложения двуокиси углерода на электродном угле в чисто кинетической области реагирования.
На рис. 26, б, в аналогичные данные приведены для реагирования двуокиси углерода с прокаленным антрацитом и древесным углем. Как видно, для чисто кинетической области реагирования CO2 в области сравнительно низких температур (до 1000—1100) реакция CO2+С во всех исследованных случаях при резко различных по характеристике сортах углерода имеет отличный от первого порядок реакции. Особенно четко отклонение порядка реакции от первого видно на рис. 26, в. Увеличение концентрации CO2, например, при 810 и 8-10 заметно влияет на выход и скорость реакции только в области весьма низких концентраций CO2 (порядка 4—8%). Повышение концентрации выше 20—25% при этих температурах вообще не ускоряет реакции. При более высоких температурах, (порядка 900—1000) область влияния концентрации CO2 на скорость реакции заметно расширяется, достигая 30—40% при 1000о.

Рис. 26. Влияние концентрации CO2 на выход окиси углерода в слое частиц электродного угля (А), антрацита (Б) и древесного угля (В)
На электродном угле резко выраженный переменный порядок реакции при температурах 900-1100 (рис. 26,а) переходит при более высоких температурах в первый порядок, а при 1180 наблюдается даже характерный изгиб кривой с видимым порядком реакции по CO2 выше первого. Такой различный ход кривых, определяющих зависимость скорости реакции CO2 + С от концентрации реагирующей двуокиси углерода, связан с различными энергиями активации реакций образования и разложения поверхностного комплекса СХОУ, а также температурных зависимостей К1 и К2 в кинетическом уравнении (32) реакции CO2 + С.
Составление макрокинетического уравнения для чисто кинетической области требует значительно большего материала, чем тот, который могут дать опыты с восстановлением CO2, поскольку без специального изучения процессов адсорбции CO2 и СО, а также их смесей и смесей СО и CO2 с азотом при различных температурах нельзя определить из опытных данных даже величины Кр и К0.
* В связи с большим влиянием Fвн в кинетической области, при работе с различными партиями углерода и даже с углеродом различных стержней могут быть отмечены довольно сильные изменения суммарной скорости реагирования.

Для составления такого уравнения необходимы также дополнительные опыты с более мелкими частицами углерода, позволяющими определить истинную величину общей реакционной поверхности Вполне понятно, что при переменном порядке реакции не представляется возможным дать достаточно точную величину даже осредненной суммарной «энергии активации» реакции. Составление осредненного макрокинетического уравнения реакции CO2+С в чисто кинетической области осложняется еще и тем, что по мере реагирования CO2 за счет значительного повышения концентрации СО в газе процесс резко затормаживается и восстановление последних процентов двуокиси углерода затягивается, как это видно из рис. 15, значительно больше, чем это следует даже из реакции первого порядка по CO2.
Для большинства практических задач, в том числе и подземной газификации, наибольший интерес представляет процесс восстановления сравнительно низких концентраций CO2 (до 20%) при температурах порядка 1000—1400. Рассмотрим, каковы суммарные кинетические характеристики, описывающие с практически достаточной точностью экспериментальный материал по реакции CO2 + С для температур свыше 900 С, когда реакция имеет заметную скорость и концентрацию CO2 ниже 20%.
Как видно из рис. 26, в пределах изменения концентраций CO2 примерно от нуля до 20—25% можно с известной точностью представить экспериментальные данные в чисто кинетической области в виде следующего приближенного уравнения:

При работе с крупнокусковым топливом и в углеродном канале, например, в условиях подземной газификации методом потока, чисто кинетическая область практического значения не имеет, так как весь процесс восстановления двуокиси углерода, как правило, протекает в кинетической области.
Опытные данные свидетельствуют и здесь о близости величины dкр (первого критического размера частиц) к расчетной.
При реагировании CO2 со стенками углеродного канала или пластинкой первая критическая толщина стенки, при которой наблюдается чисто кинетическая область, будет меньше половины dкр, т. е. будет меньше 1 мм.
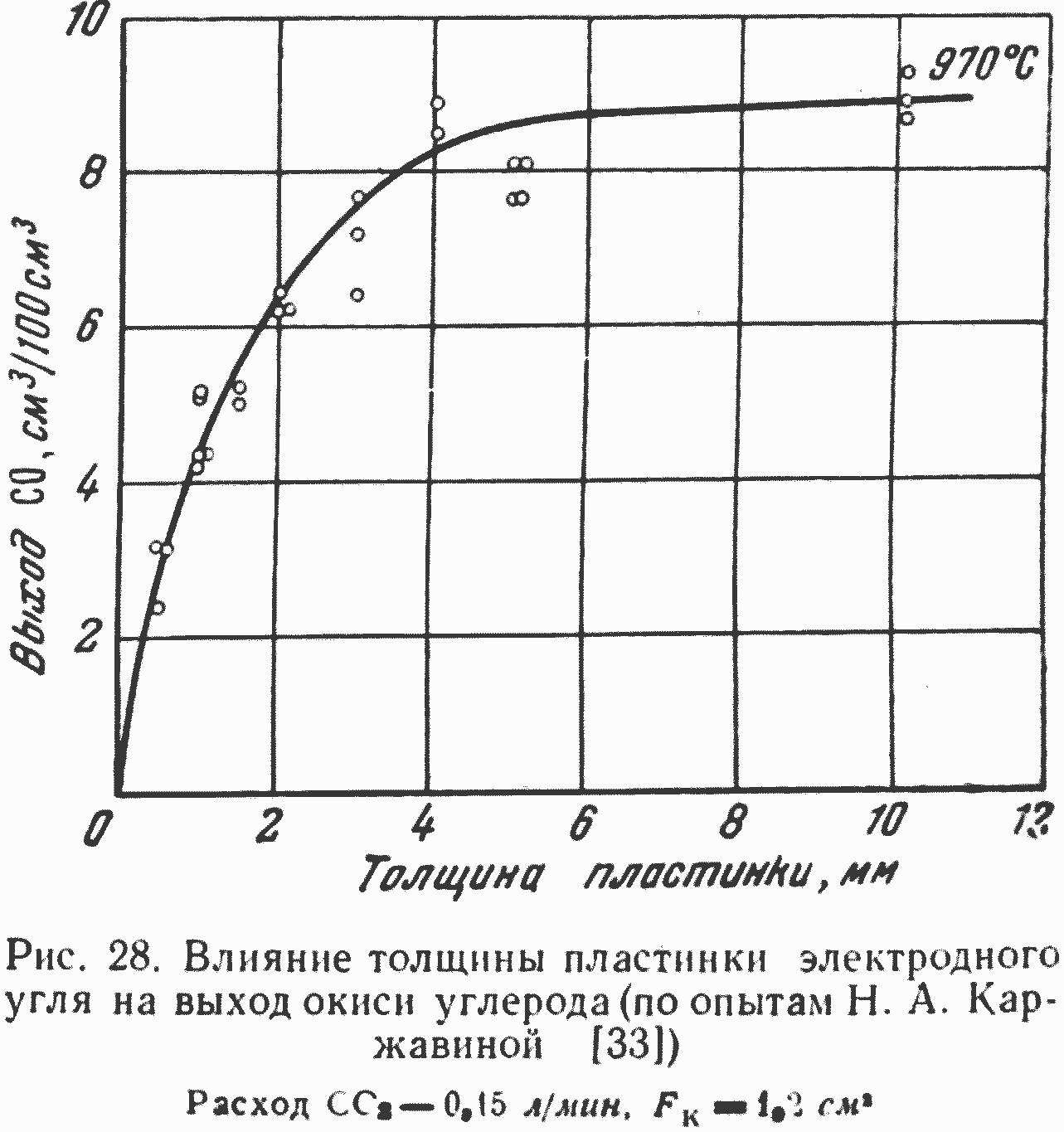
Для односторонне контактирующей (открытой) с реагирующим газом углеродной пластинки или стенки канала изменение ее толщины до критической величины будет приводить к пропорциональному увеличению выхода реакции на единицу поверхности пластинки или стенки углеродного канала. Как только толщина стенки углеродного канала или пластинки превысит первое критическое значение, интенсивность роста выхода реакции снизится и при дальнейшем увеличении толщины, когда она достигает второго критического значения, соответствующего переходу процесса в кинетическую область, увеличение выхода реакции прекратится. Такой ход процесса наглядно показан на рис. 28, где представлены результаты опытов Н. А. Каржавиной [32] с пластинкой, доступной для реагирования с CO2 только с одной стороны.
Как видно из рисунка, линейный рост выхода реакции, как и следовало ожидать, сохраняется до толщины пластинки меньше 1 мм, когда концентрация CO2 по всей глубине пластинки практически одинакова и равна концентрации двуокиси углерода в газовом объеме. Вторая критическая толщина, как видно из рисунка, составляет около 3,5—4,0 мм и соответствует глубине практически заметного проникновения CO2 в массу пластинки электродного угля. Эта точка имеет большое значение, так как характеризует переход гетерогенного процесса реагирования CO2 с углеродом в кинетическую область, наиболее распространенную в работе промышленных печей и газогенераторов, в том числе и подземных.
Для теоретического определения второй критической точки, т. е. границы между первой переходной и кинетической областями реагирования CO2 с углеродом, воспользуемся уравнением (12), определяющим изменение концентрации CO2 по толщине пластинки углерода.

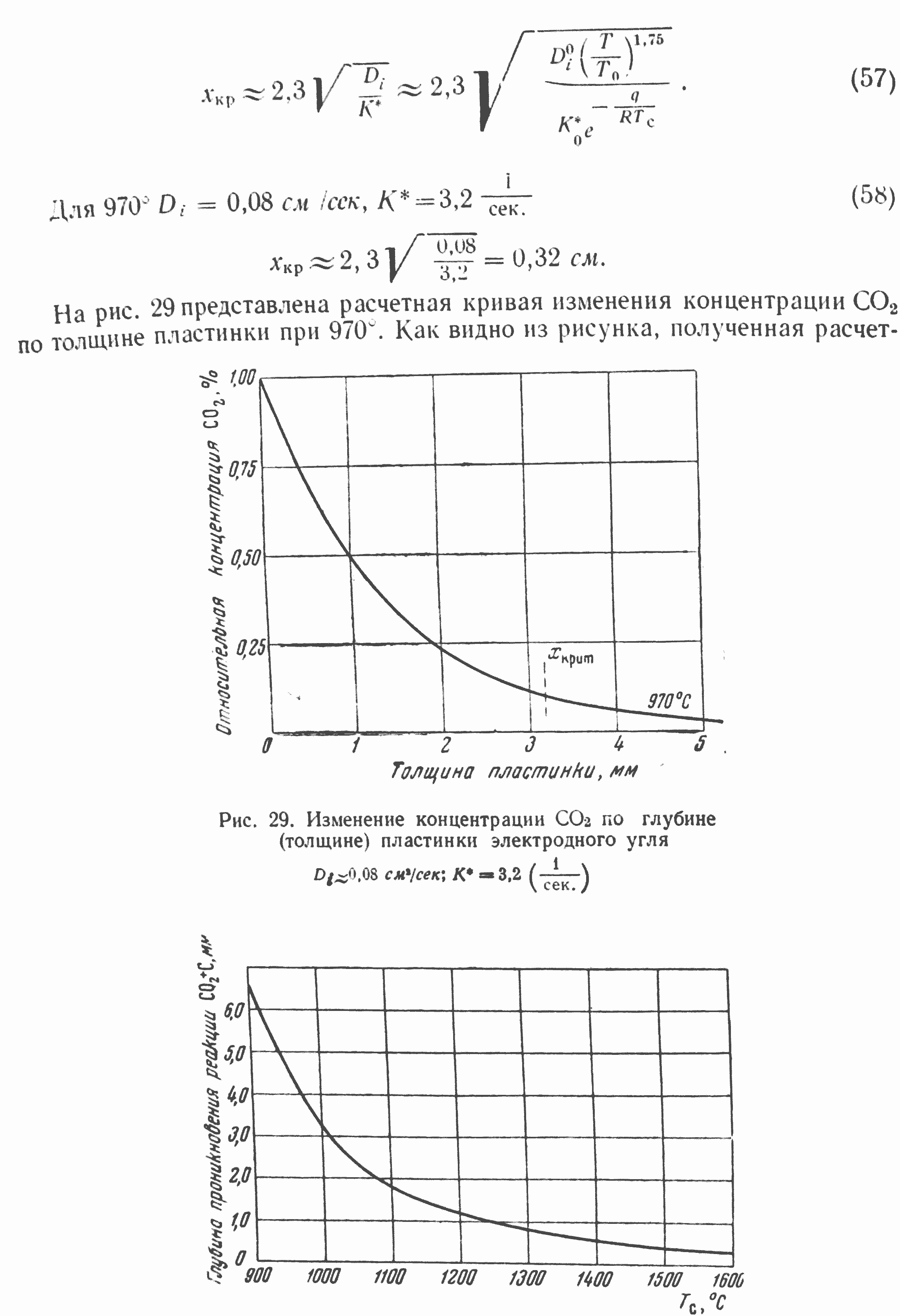
Рис. 30. Влияние температуры на глубину проникновения двуокиси углерода в пластинку электродного угля (вторую критическую точку)
Как видно из рисунка, полученная расчетным путем вторая критическая точка близка экспериментально определенной (см. рис. 28) по интенсивности реагирования CO2 на пластинках различной толщины. Изменение температуры реагирования, как показывает рис. 30, сильно влияет на величину хкр — второй критической точки в глубине реагирующего углерода.
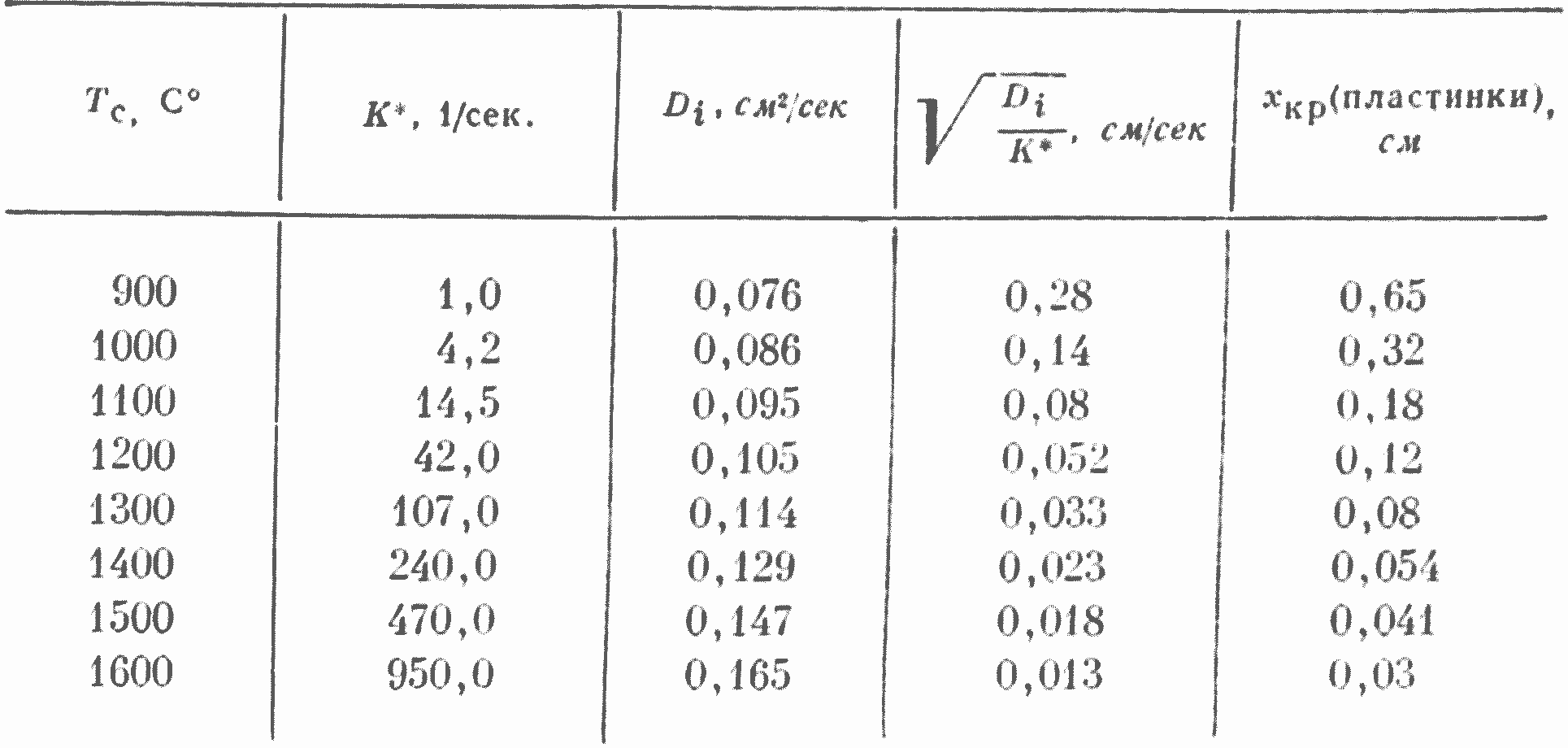
Значения К*, Di и др. величин для различных температур приведены в табл. 1.
Таблица 1
Влияние температуры на некоторые показатели реакции CO2 + С (углеродная пластинка)
Графики рис. 27 и 30, иллюстрирующие значения первой и второй критических точек, наглядно показывают, почему в опытах Вулиса не было обнаружено влияние толщины стенок углеродного канала на скорость реакции CO2+С. Минимальная толщина стенок канала в 2,5 мм, которую авторы применяли в своих опытах, находится на грани проникновения CO2 внутрь частиц даже для температуры 1000. Для более высоких температур вторая критическая точка меньше 2,5 мм, а, следовательно, всякое увеличение толщины стенок канала в этих условиях не могло привести к заметному повышению интенсивности разложения CO2.
Из приведенного анализа вытекает важный выгод, который можно сформулировать следующим образом.
Реакция восстановления CO2 углеродом протекает в основном на внутренней реакционной поверхности углерода для всех температур, имеющих практический интерес для восстановительной зоны большинства промышленных аппаратов.
Реакционная поверхность даже для температур порядка 1400—1600 С во много раз превышает внешнюю геометрическую (контурную) поверхность крупных кусков кокса или углеродного канала.
Этим в значительной мере объясняется резкое несоответствие результатов опытов с коксом при атмосферном давлении и опытов в вакууме с непористой графитовой нитью.
Характерной особенностью кинетической области, как мы уже отмечали, при общем анализе гетерогенных реакций являются аналитическая зависимость, аналогичная чисто поверхностному (Ек) процессу, и зависимость скорости реагирования от концентрации двуокиси углерода, формально близкая первому порядку реакции. Эти особенности значительно упрощают расчет в этой важной области гетерогенного реагирования. При размере частиц, примерно в 3—8 раз превышающем хкг, практически наблюдается кинетическая область реагирования как для отдельных частиц, так и в слое и в газовзвеси. Видимый (фиктивный) первый порядок реакции CO2+С в кинетической области наблюдается потому, что внутреннее реагирование, как мы установили, изменяет замеряемый порядок реакции, приближая его к первому, даже тогда, когда истинный порядок близок к нулевому или, во всяком случае, значительно ниже первого.
Вследствие различной зависимости К0 и КР от температуры, а также в связи с влиянием изменения К1 и К2, повышение температуры уже при 1100—1150 приводит к макрокинетическому первому порядку и для чисто кинетической области. Для этой температуры приведенная константа скорости реакции в кинетической области Кпр может быть определена по уравнению (11) из К*. При других температурах этот расчет не даст точного результата потому, что первый порядок реагирования получается в результате приближенного упрощения действительной зависимости в конкретных условиях.
Приближенные, достаточные для практических целей, значения Кпр могут быть получены путем экспериментальных исследований реакции CO2+С. Наиболее точные данные можно получить из опытов с углеродным каналом
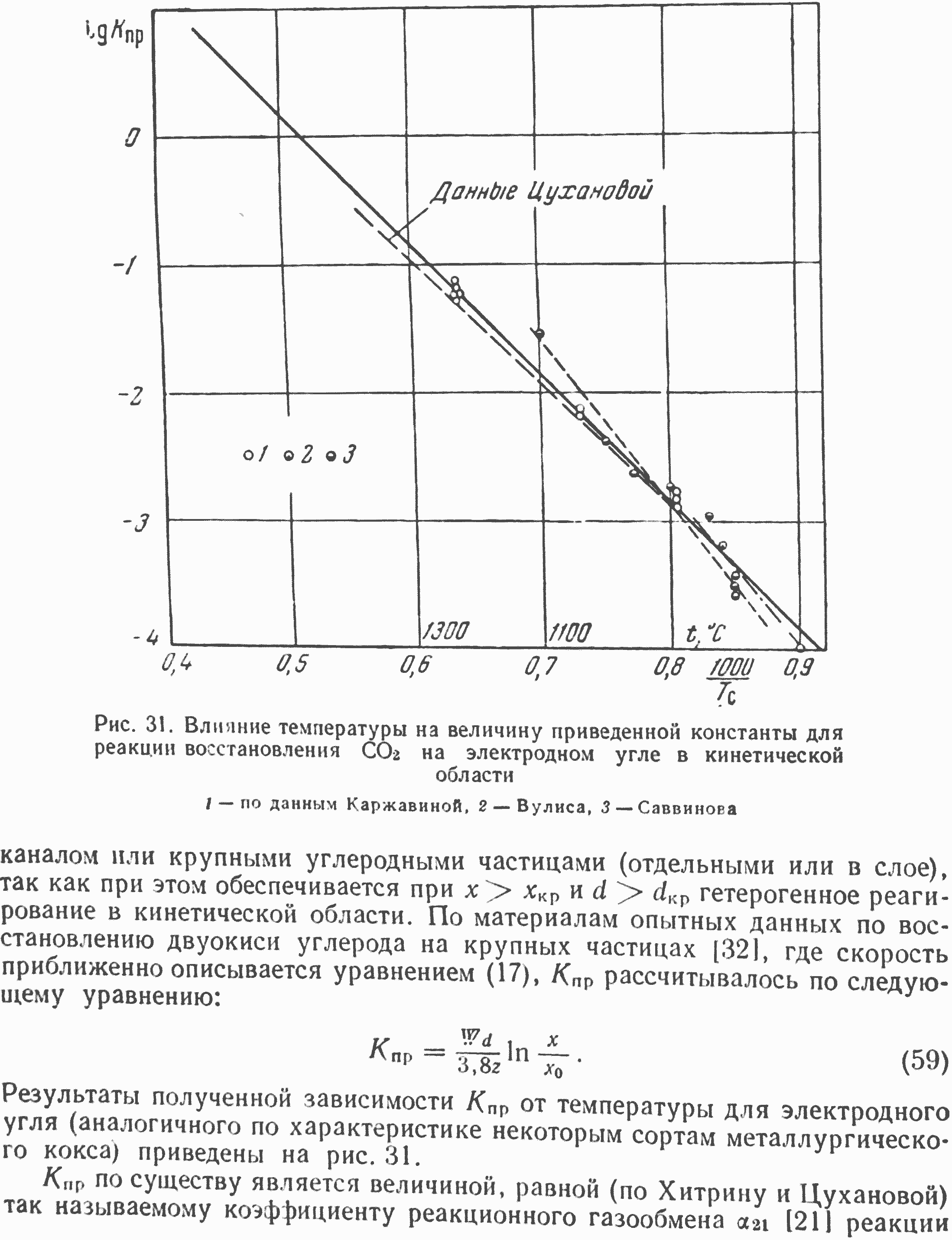

где Кпр дано в м/сек, а Тс — в градусах Кельвина. На этом же рисунке представлены и экспериментальные данные М. И. Саввинова [42], который исследовал восстановление СОз в области низких температур на шарике электродного угля диаметром 1,5 см. В условиях этой работы в связи с применением крупных шариков углерода, несомненно, имелась некоторая неизотермичность реагирования. Это исследование, кроме кинетической области, захватывает также первую переходную область.
Полученные значения Кпр для всех использованных нами достаточно достоверных экспериментальных данных хорошо совпадают между собой, что убедительно свидетельствует о том, что Кпр не является специфичным для конкретных условий эксперимента, а характеризует процесс взаимодействия CO2 с углеродом в кинетической области и не зависит от аппарата, в котором этот процесс осуществляется. Представленные на рисунке данные по электродному углю могут быть использованы для расчета восстановления CO2 в любых конкретных условиях. К сожалению, процесс реагирования СОз при высоких температурах (выше 1400) экспериментально не исследован, и расчет его может проводиться только на основании экстраполяции по уравнению (61). Для точных расчетов при высоких температурах, а также высокой степени разложения CO2 (свыше 50—70%) требуются дополнительные исследования, которые позволят скорректировать приводимую на рисунке зависимость. В случае приближенных расчетов можно использовать уравнение (61) и для более высоких температур, порядка 1600— 2000°.
Воспользуемся теперь полученными кинетическими характеристиками реакции CO2+С для определения границ кинетической, второй переходной и диффузионной областей реагирования. Если в условиях кинетической области концентрация CO2 у контурной поверхности практически (в пределах 10%) была равна концентрации в газовом объеме и общая интенсивность подвода CO2 к контурной поверхности углерода не тормозила процесс, то, как мы показали выше, во второй переходной области это условие нарушается. Здесь концентрация двуокиси углерода у внешней поверхности углерода заметно отличается от концентрации в газовом объеме и суммарная скорость реакции заметно тормозится конвективным и молекулярным переносом — диффузией CO2 из газового объема к внешней контурной реакционной поверхности.

Для конкретных гидродинамических условий взаимодействия CO2 с углеродом кокса, используя полученные нами материалы, можно с достаточной точностью определить границы диффузионной и кинетической областей реакции CO2+С.
Граница кинетической области определится уравнением


Как видно из рис. 32, для восстановительной зоны газификации газовзвеси граница кинетической области реакции CO2+С находится для частиц в 100 μ примерно при температуре реагирующей поверхности, равной 1700 , для частиц в 500 μ при 1400о и для миллиметровых частиц при 1300. Диффузионная область для газовзвеси практически, в обычных условиях, не достижима, так как лежит выше 2000о даже для крупных частиц.
Для восстановительной зоны газификации плотного слоя коксовых частиц граница кинетической и диффузионной областей зависит от величины Re. Для Re≈200 граница кинетической области находится для частиц в 20 мм при температуре реагирующей поверхности, равной около 1200, для частиц в 8 мм около 1300о и для частиц в 2 мм около 1500. Граница диффузионной области реагирования для плотного слоя, как и для газовзвеси, превышает для большинства случаев 2000.
Как известно, большая часть исследовании реакции CO2+С выполнялась на слое мелких частиц кокса, размером 2—5 мм. Совершенно очевидно, что для этих условий обнаружить даже небольшое гидродинамическое влияние скорости газового потока на скорость реакции CO2+С можно только для температур, превышающих 1300—1400°. В тех экспериментальных исследованиях, в которых влияние скорости газового потока на скорость реакции CO2+С обнаруживалось при более низких температурах, оно было связано с экспериментальными ошибками или, точнее, с неправильной постановкой эксперимента, определяющего удельную скорость реакции при заданной температуре.
Наибольший интерес как в методическом отношении, так и для процесса подземной газификации углей имеет восстановительная зона газификации в коксовом канале, т. е. протекание реакции CO2+С в углеродном канале. Как видно из рис. 33, при турбулентном газовом потоке граница кинетической области находится для канала d—1,0 м и Re — 500 003 при температуре реагирующей поверхности около 1200, для канала d — 3,4 м — около 1303 и для канала d — 0,2 м — около 1450.
Диффузионная область реагирования также находится в границах весьма высоких температур. Даже вторая переходная область со значением Sm — 1,0 находится для канала d — 1,0 м примерно около 1500°, а для канала d — 0,4 м около 1700o.
Для небольших размеров углеродного канала (— 8 мм) даже при ламинарном режиме кинетическая область распространяется примерно до 1200-1250 . Таким образом, почти все исследования О. А. Духановой были проведены в кинетической области протекания реакции CO2+С. То же самое можно сказать и об опытах Вулиса и Витмана. Обнаруженное Вулисом влияние скорости газового потока на интенсивность процесса восстановления двуокиси углерода на стенках углеродного канала было связано, видимо, в условиях опыта с влияниями изменения концентрации окиси углерода в газе и скорости газового потока на температурный режим реакции.
Изучение реакции восстановления двуокиси углерода имеет, несомненно большое практическое значение для многих технических процессов, протекающих в топках, газогенераторах и разнообразных промышленных печах. но максимальное значение оно имеет для процесса п. г. у., наименее доступного для непосредственного контроля.

Мы уже отмечали, что с теоретической стороны наибольший интерес и значение представляет исследование температурной зависимости скорости реакции в чисто кинетической и в кинетической областях реагирования, так как имеется некоторое противоречие в теоретическом и практическом соотношении этих скоростей при различных температурах реагирования. Теоретически кажущаяся (замен яемая) энергия активации реагирования в кинетической области должна, как показывает уравнение (11), быть примерно в два раза меньше осредненного значения энергии активации реагирования в чисто кинетической области. Экспериментальные исследования показывают, однако почти одинаковые температурные зависимости как К, так и Кпр, т. е. близкие значения осредненных энергий активации.

В настоящее время невозможно дать полное и однозначное определение причин этого противоречия из-за недостатка экспериментальных данных по кинетике адсорбции СО и CO2 и изучению характеристики строения поверхности реагирующего углерода. Наличие этого кажущегося противоречия связано, конечно, со сложным механизмом реакции, включающей хемосорбционную стадию окислов углерода. и, возможно, с влиянием водяных паров, присутствующих в газе. Только тщательное изучение действительного механизма, а также микро- и макрокинетических характеристик реакций CO2+С и H2О+С позволит правильно осветить противоречие теоретической и экспериментальной температурных зависимостей К* и Кпр.

