Глава III. ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА
§ 1. Химические действия тока
Растворы кислот, щелочей и солей являются проводниками электрического тока и называются электролитами. Молекулы этих веществ под действием растворителя расщепляются на две части, которые оказываются разноименно заряженными. Положительные и отрицательные части молекул являются переносчиками электричества в электролитах и называются ионами. Таким образом, в жидкостях электрический ток обусловлен движением ионов. При этом положительным ионом называется атом, в котором недостает электронов, а отрицательным — в котором электронов в избытке.
Электролит помещается в сосуд, обычно называемый электролитической ванной. Если в электролит опустить два проводника (электрода), соединенных с источником постоянного тока, то, в результате действия электродвижущей силы источника, в электролите произойдет упорядоченное движение ионов. Электрод, соединенный с положительным зажимом источника, называется анодом, а с отрицательным — катодом. При этом ионы с отрицательным зарядом будут двигаться к аноду, а катионы с положительным зарядом — к катоду.
Процесс разложения электролита называется электролизом.
В результате действия электрического тока на электродах выделяется определенное количество веществ, содержащихся в виде химических соединений в электролите. Это явление широко используется в технике (покрытие одного металла слоем другого, очистка металлов от примесей и т. д.).
В химических источниках тока электродвижущая сила образуется в результате химической реакции, происходящей внутри элемента. Один полюс становится положительным, а другой — отрицательным.
К химическим источникам тока относятся гальванические элементы и аккумуляторы. Отличаются они друг от друга тем, что химические процессы в гальваническом элементе необратимы (каждый элемент после одного цикла действия приходит в негодность), а аккумуляторы после расхода энергии поддаются периодическим перезарядкам.
§ 2. Гальванические элементы
Для питания электрических цепей с незначительным потреблением энергии пользуются простейшим химическим источником тока, каким является угольно-цинковый элемент. Электродами в нем служат уголь и цинк, а электролитом — растворы кислот или солей.
При погружении в электролит на одном электроде возникает избыток электронов, а на другом — недостаток их. Соответственно, один электрод будет отрицательным, а другой — положительным. Возникнет электродвижущая сила, величина которой определяется материалом, из которого изготовлены электроды, и химическим составом электролита. Если цепь замкнуть, то в ней появится ток.
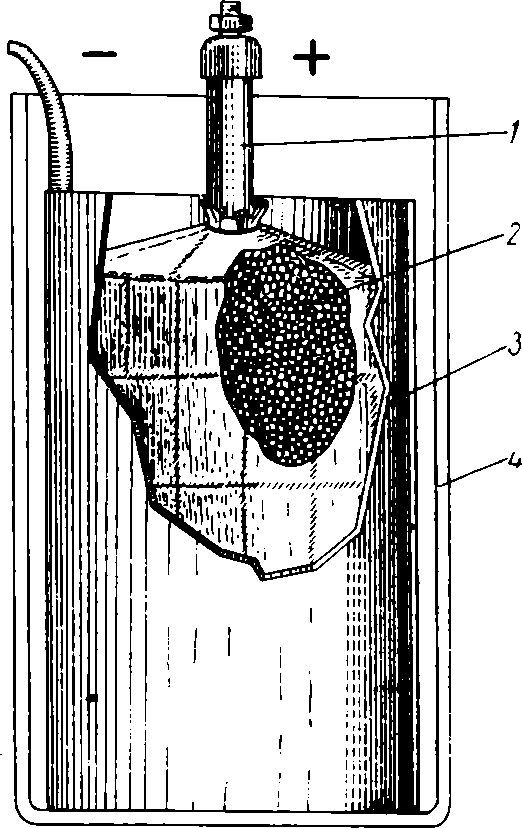
Рис. 6. Угольно-цинковый сухой элемент:
1 — угольный электрод; 2 — агломерат; 3 — цинковый электрод; 4 — сосуд.
Срок действия этого элемента ограничен, так как во время работы приходит в негодность электролит и под действием электролита портится (разъедается) цинковый электрод.
Рассмотренный угольно-цинковый элемент носит название мокрого элемента.
Принципиальное отличие сухого элемента от мокрого состоит в том, что электролитом в нем служит густая масса, а в качестве электродов используются цинк и уголь. Отрицательным электродом является сам корпус (сосуд) элемента, выполненный из цинка. Положительный электрод помещается внутри сосуда в виде угольной палочки или пластинки. Угольный электрод обычно помещают в мешок, заполненный электролитом, который, в свою очередь, приготовляется в виде густой массы из некоторых веществ (агломерат). Для образования такой смеси используется обычно уголь или графит с перекисью марганца (рис. 6). Напряжение сухого элемента не превышает 1,3—1,5 в.
§ 3. Кислотные аккумуляторы
Электродами в кислотном аккумуляторе являются свинцовые пластины, а электролитом — раствор серной кислоты. Для возникновения в аккумуляторе электродействующей силы его необходимо зарядить от какого-нибудь источника постоянного тока. В данном случае в аккумуляторе произойдет разложение серной кислоты, один из электродов (анод) окислится и покроется слоем перекиси свинца — аккумулятор зарядится. При отключении постороннего источника тока и включении аккумулятора на внешнее сопротивление в цепи пойдет ток. При разрядке аккумулятора химические процессы будут противоположны тем, которые наблюдались при его зарядке.
Количество энергии, которое может отдать аккумулятор во внешнюю цепь во время разряда, называется емкостью аккумулятора (измеряется в ампер-часах). С увеличением поверхности пластин емкость возрастает. С этой целью в аккумуляторах их объединяют в группы. Число отрицательных пластин при этом получается на одну больше, так как каждую положительную из них размещают среди двух отрицательных. Поверхность пластин, за исключением крайних, практически используется с двух сторон. Между пластинами размещают изоляционные прокладки (сепараторы).
Для увеличения емкости пластины изготавливают решетчатого типа и заполняют специальной активной массой, способствующей увеличению емкости (рис. 7).
Коэффициент полезного действия аккумулятора очень высокий — 75%.
§ 4. Щелочные аккумуляторы
Эти аккумуляторы (рис. 8) называются щелочными, так как электролитом для них служат раствор и щелочи с некоторыми добавками других веществ.
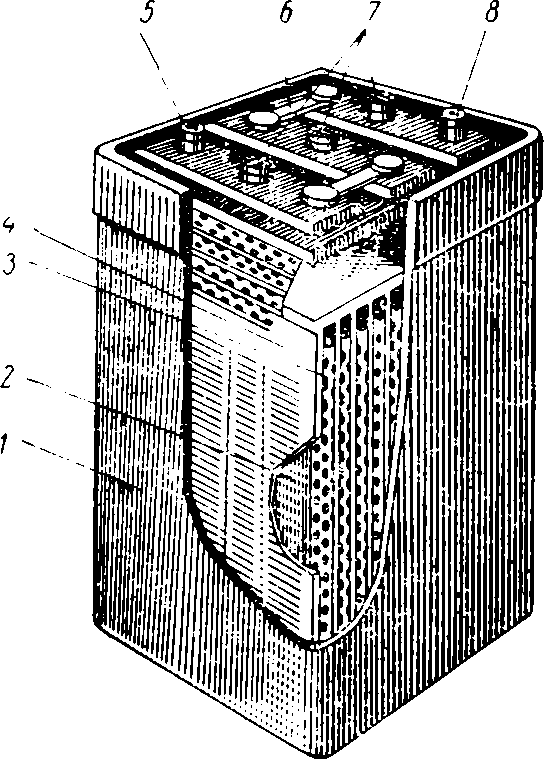
Рис. 7. Кислотный аккумулятор:
1 — корпус; 2 — сепаратор; 3 — положительная пластина; 4 — отрицательная пластина; 5 — положительный полюс; 6 — межэлементное соединение; 7 — пробка, закрывающая отверстие для заливки электролита; 8 — отрицательный полюс.
Корпусы (банки) для этих аккумуляторов применяют из никелированного железа. Электродные пластины имеют вид железных рамок с множеством отверстий, заполненных активной массой. Пластины с положительным зарядом соединены с корпусом аккумулятора, а с отрицательным — изолированы от корпуса. Отрицательные пластины располагают между положительными.
Коэффициент полезного действия щелочных аккумуляторов равен 95%. Электродвижущая сила их вдвое ниже, чем у кислотных. В то же время щелочные аккумуляторы обладают и целым рядом преимуществ. Они, в частности, хорошо переносят сотрясения, а также аварийные режимы, не портятся при коротких замыканиях. Вес их значительно меньше, чем кислотных.
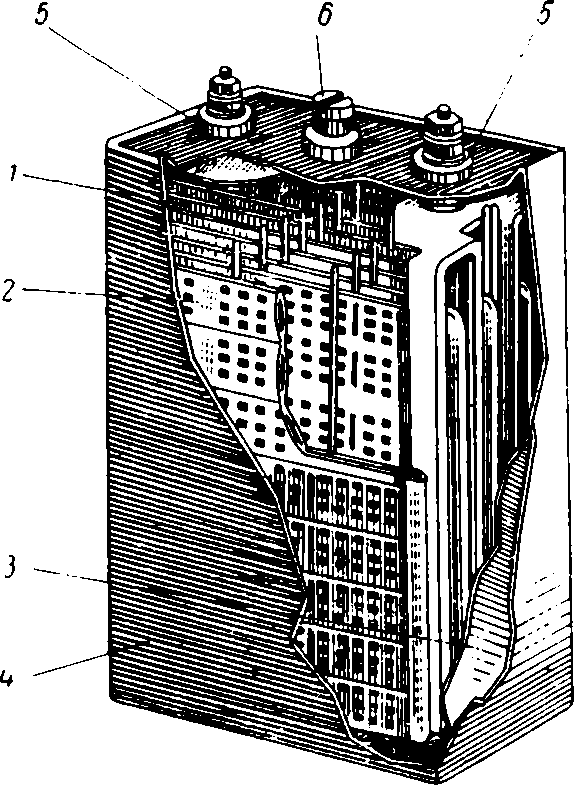
Рис. 8. Щелочной аккумулятор:
1 — блок отрицательных пластин; 2 — блок положительных пластин; 3 — изолирующая прокладка; 4 — корпус; 5 — изоляторы; 6 — пробка.
Наряду с рассмотренными имеются также другие источники тока, например окисно-ртутные элементы, в которых анодом является цинковый порошок, а катодом — окись ртути. Характерная особенность этих элементов — постоянство напряжения при разряде, лишь в конце его напряжение резко снижается до нуля. Промышленность выпускает также серебряно-цинковые аккумуляторы.
§ 5. Соединение источников тока в батареи
Для получения большего напряжения химические источники тока объединяют в батареи.
При последовательном соединении (через разноименные полюсы) электродвижущая сила возрастает во столько раз, сколько соединяется источников.
При параллельном соединении (одноименные полюсы всех соединяемых источников соединяются вместе, образуя два общих полюса — положительный и отрицательный) общая электродвижущая сила не возрастает, однако увеличивается емкость и максимальный ток при разряде.
На практике распространение получило смешанное соединение, при котором все источники подразделяются на две равные группы. В каждой из них все источники соединяются друг с другом последовательно, а затем две группы между собой параллельно. Смешанное соединение позволяет одновременно получить высокую электродвижущую силу, большую емкость и максимальный ток при разряде.
§ 6. Эксплуатация химических источников тока
В качестве источников тока там, где требуется небольшое напряжение (маломощные радиоприемники, электрические фонари и т. д.), находят применение гальванические элементы. Они работают на износ и эксплуатация их несложна.
Аккумуляторы, как источники тока, применяются в более мощных устройствах, и при эксплуатации их необходимо соблюдать определенные правила.
Электролит в аккумулятор надо заливать так, чтобы он покрыл полностью пластины. При этом новый аккумулятор после заполнения его электролитом включают в работу через 6 часов. Надо дать возможность активной массе пропитаться электролитом.
Кислотный аккумулятор для зарядки подключается одноименными полюсами к источнику тока. Напряжение источника должно быть немного больше электродвижущей силы аккумулятора, ток — не более 1/10 части емкости аккумулятора. Если емкость аккумулятора 50 а-ч, то зарядный ток не должен превышать 5 а. Заряд можно и даже целесообразно производить меньшим током. В этом случае время соответственно увеличивается.
При разрядке следует следить, чтобы разрядный ток не превышал 1/10 емкости аккумулятора. Кислотные аккумуляторы очень чувствительны к току короткого замыкания.
Аккумуляторы разряжаются даже тогда, когда они не находятся в работе. В результате саморазряда каждые сутки теряется до 1 % емкости. Поэтому аккумулятор раз в месяц в любом случае требует подзарядки независимо от того, находился он в работе или нет. Если аккумулятор вовремя не подзаряжать, то его пластины покроются белым налетом из сернокислого свинца, который приводит к уменьшению емкости.
Зарядный ток щелочного аккумулятора принимается равным 1/4 емкости аккумулятора, а разрядный должен составлять не более 1/8 емкости.
Аккумуляторы представляют опасность как в пожарном отношении, так и для обслуживающего персонала из-за выделения ими вредных для организма паров. Поэтому хранить их нужно в специальных помещениях. При этом кислотные и щелочные аккумуляторы надо устанавливать в различных помещениях. Там, где размещаются аккумуляторы, стены, потолок и все другие детали должны быть покрыты кислотно- или щелочеупорной краской. Помещения должны хорошо вентилироваться. За аккумуляторными батареями требуется постоянный надзор. Анализ электролита производится не реже одного раза в 3 года. Ремонт аккумуляторных батарей, как правило, производится в специализированных мастерских.
§ 7. Топливные элементы
Топливный элемент является электрохимическим генератором, в котором химическая энергия горючего непосредственно превращается в электрическую, в чем и состоит преимущество топливных элементов перед другими существующими способами получения электроэнергии.
Топливные элементы состоят из двух электродов — положительного и отрицательного, погруженных в электролит. К одному электроду подводится топливо, к другому — окислитель. Во время работы элементов происходит окислительно-восстановительная химическая реакция, в результате которой в замкнутой внешней цепи, соединяющей электроды, возникает постоянный электрический ток.
Топливо может быть самое разнообразное: водород, уголь, природные топливные газы и т. д. Электролитом служат щелочные растворы, расплавы некоторых солей. В качестве окислителя применяется кислород. Можно применять и воздух, но в этом случае показатели генератора ухудшаются. Принципиальная схема топливного элемента показана на рис. 9.
Электрохимическое «сжигание» топлива происходит в баллоне с электролитом.
На одном из электродов — аноде молекулы топлива переходят в электролит в виде положительных ионов с отдачей в цепь соответствующего количества электронов. На катоде кислород приобретает эти электроны и также переходит в электролит, но в виде отрицательных ионов, и во внешней цепи возникает ток, а в электролите положительные и отрицательные ионы, соединяясь, образуют продукт реакции. В кислородно-водородном топливном элементе продуктом реакции является вода.
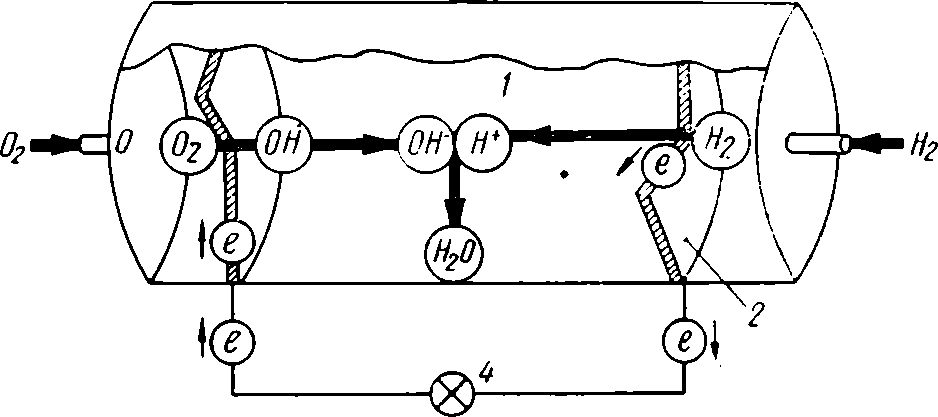
Рис. 9. Принципиальная схема кислородно-водородного топливного элемента:
1 — электролит; 2 — анод; 3 — катод; 4 — нагрузка.
Топливные элементы имеют очень высокий коэффициент полезного действия, теоретически близкий к 100%. Они несложны в изготовлении, просты в эксплуатации, бесшумны в работе. Недостатком топливных элементов является то, что, вследствие окисления, быстро выходят из строя электроды. Чтобы удлинить срок службы элементов, приходится использовать в качестве электродов дорогостоящие материалы.
Топливные элементы в настоящее время применяются в качестве источников электроэнергии на космических кораблях и искусственных спутниках Земли. В то же время проводятся экспериментальные работы по созданию самоходных машин, работающих на топливных элементах.

