3.3.2. Термодинамика образования водорода в реакциях алюминия, кремния и железа с водой
Ниже на основе табулированных значений величин [87] рассчитаны изменения энергии Гиббса реакций взаимодействия алюминия, кремния и железа с водой и водяным паром. Ранее исследована термодинамика следующих реакций [50, 145, 173]:

Авторы указанной выше литературы, отдавая дань традиции, используют соотношение
![]()
где CP — теплоемкость при P — const.
Наличие в современной литературе табулированных значений H0(T)—H0(0) или H0(T)—H0(298) позволяет упростить расчет изменения энтальпии реакции.
Типы возможных реакций, включая приведенные выше, даны на рис. 30. Здесь же представлены расчетные значения энергии Гиббса. С осредненными величинами этой энергии мы уже познакомились на рис. 19. Стехиометрические соотношения веществ устанавливались после оценки состава продуктов реакции.
При взаимодействии алюминия или его оксида с влажной атмосферой образуется ряд продуктов: гидраргиллит γ-А1(ОН)з, байерит α-А1(ОН)з, бемит γ-AlO(OH), диаспор α-AlO(OH), γ- и α-A2O3[119,124, 175-177].
С ростом температуры продукты претерпевают ряд изменений. Так, гидраргиллит при нагреве до 200+250 °С переходит в бемит. Байерит при 200+300 °С — в бемит. Бемит при 300+450 °С превращается в η- или γ-Al2O3, диаспор при 450+500 °С — в α-Al2O3.
По химическому составу смесь гидраргиллита и байерита можно рассматривать как бетагиббсит AUO3 ·3Η2Ο, а смесь бемита и диаспора — как метагидрооксид Α12Ο3·Η2Ο [119, 145]. Возможно также наличие псевдобемита А12О3·1,3Н2О [178]. Авторы работы [178] отмечают, что при температуре 20+90 °С оксидная пленка трехслойная: непосредственно на поверхности алюминия — аморфный оксид или гидрооксид толщиной в несколько нанометров, далее — слой псевдобемита и поверх него — слой байерита. Толщины псевдобемита и байерита измеряются микронами. В интервале температур 100+374 °С оксидная пленка состоит из бемита, однако на наружной поверхности обнаружены столбчатые кристаллы диаспора. Наружный слой отделен от поверхности металла тонким слоем γ-A12O3. При температуре выше 374 °С (критическая точка воды) оксидная пленка состоит из γ^^ и a-Al2O3 (корунда).
Кроме того, отмечается, что при температуре 500+900 °С возможна реакция расплавленного алюминия и продуктов его взаимодействия с парами воды. При этом оксиды алюминия частично переходят в газообразную форму (реакции 5 и 6), а частично растворяются в жидком алюминии и образуют комплексные соединения типа (Al2O3)хН или (Al2O3 • nН2О)yH [119].
Кремний при низкой температуре разлагает воду по уравнению 7 на рис. 30. В случае если температура превышает 600 °С, реакция развивается по зависимости 8 на рис. 30 [116, 128].
Во время железо-парового способа получения водорода при 570 °С равновероятно присутствие компонентов: Fe3O4, FeO и Fe. Выше 570 °С образуется оксид Fe (II) и водород. При более низких температурах наиболее устойчивым является Fe3O4 (см. уравнение 9 на рис. 30) [173, 178]. В выражении 10 на рис. 30 Fe3O4 взят как суммарный оксид, т.е. FeO и Fe2O3 [128, 173, 179].

Рис. 30. Изменение величины энергии Гиббса в зависимости от температуры
Полученные значения энергии Гиббса свидетельствуют о высокой вероятности реакций кремния и алюминия с водой. Реакции железа также возможны, но с повышением температуры снижается полнота реакции.
В зонах газообразования поверхности алюминия и кремния раскалены, что приводит к вскипанию поступающей на реакцию воды [149].
Равновесная термодинамика не учитывает фактор времени и характер переходных процессов, хотя и накладывает определенные ограничения на кинетику процесса. Так, выполнение стехиометрических соотношений между реагентами и продуктами реакции означает, что для каждой реакции имеется одно и только одно независимое кинетическое уравнение. Одним из компонентов исследуемых систем является газ, что позволяет при определении равновесия использовать сведения нетермодинамического характера. В частности, появление в структуре основных уравнений термодинамики константы равновесия и парциальных давлений обусловлено применением уравнения состояния идеального газа. Между константой равновесия и константами скорости прямой и обратной реакции существует взаимосвязь, позволяющая по двум величинам найти третью [174]. Так, согласно Вант-Гоффу уравнение изотермы реакции, связывающее величину константы равновесия с изменением термодинамического потенциала, имеет вид
![]()
где ΔGi — изменения энергии Гиббса; R — газовая постоянная; T — температура.
С другой стороны, согласно закону действующих масс, константа равновесия реакций определяется из выражения
![]()
где P — давление газа; vi, vj — стехиометрические коэффициенты компонентов.
Рассчитав константу равновесия и зная давление водорода в реакторе, можно определить упругость водяного пара. Тем самым производят оценку чистоты получаемого водорода.
Полноту реакции или степень разложения вещества находят с помощью константы равновесия по известным методикам [41].
Так, полнота реакции алюминия с водяным паром связана с константой равновесия уравнением
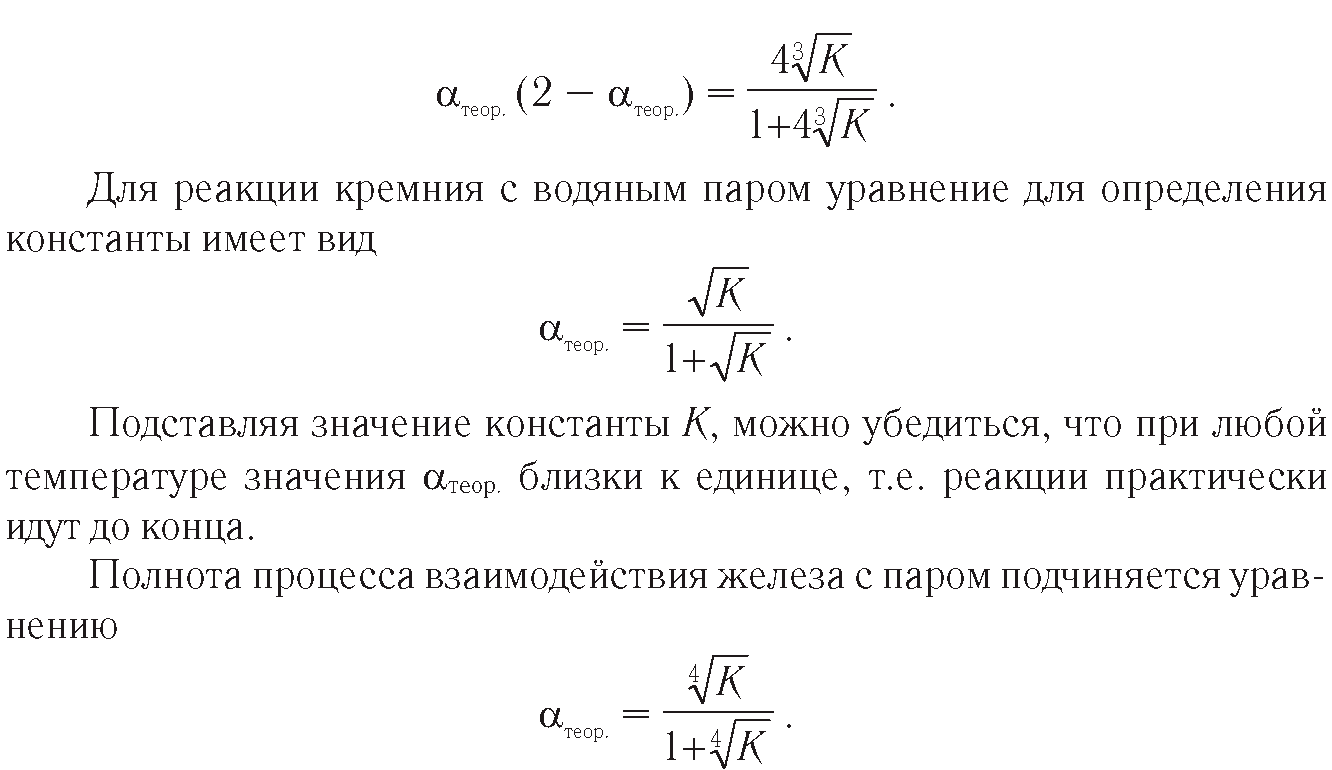
Расчетное значение αтеор. для этого случая изменяется от единицы при низких температурах до атеор.= 0,72 при температуре 1000 К.
Повышение давления не влияет на величину константы, но смещает равновесие в направлении уменьшения числа молей присутствующих газов. В связи с этим необходим дополнительный анализ условий проведения реакции железа с водой. Константа равновесия рассматриваемой реакции связана с давлением водорода зависимостью
![]()
При температуре 600 К подъем давления водорода до 269,5 МПа приводит к состоянию равновесия. Поэтому развиваемое в автономных реакторах давление в 15 МПа не может сместить равновесие реакции.
Реакции взаимодействия сплавов с водяным паром более информативны, чем реакции с водой. Экспериментально определив общее давление и приняв давление водяного пара равным давлению насыщения (при заданной температуре), можно найти парциальное давление водорода. Последнее обстоятельство позволяет оценить, насколько данный режим ведения реакции отличается от равновесного. Трудность заключается в определении упругости водяного пара непосредственно над реакционной поверхностью, поскольку на ней находится слой оксида.
Для реакции алюминия с водяным паром мы имеем ![]()
Приняв давление водорода равным 15 МПа при температуре, например, 500 К, находим равновесное давление пара Pпара = 7,7·10-15 МПа. Малая величина давления свидетельствует о возможности получения водорода высокой чистоты. Этот же расчет говорит о том, что незначительной упругости водяного пара соответствует сверхвысокое давление водорода. Вместе с тем в замкнутой системе равновесное давление может развиваться лишь при сокращении ее объема на величину разницы объемов конденсированных исходных и конечных веществ. В противном случае давление водорода не достигает равновесного. Так, для реакции 1 на рис. 30 давление в замкнутом объеме реактора не может превышать 119,3 МПа. Поскольку в реакторе имеется избыток воды по отношению к стехиометрическому количеству, водород насыщается водяным паром. Влагосодержание парогазовой смеси определяется по зависимости [180]
![]()
где Мп, Мг — молекулярные массы пара и газа; φ — относительная влажность газа;
Робщ, Рнас — общее давление парогазовой смеси и давление насыщенного пара при заданной температуре, МПа.
Если принять температуру в реакторе 200 °С и давление 15 МПа, то при полном насыщении водорода (φ = 1) и Рнас = 1,58 МПа значение x составит 0,89 кг пара на 1 кг сухого водорода.
Использование табулированных значений термодинамических величин позволило повысить точность расчетов энергии Гиббса по сравнению с принятой ранее на 5+9 %.
Таким образом, в термодинамических исследованиях расширен круг анализируемых реакций для алюминия и кремния и введены в рассмотрение реакции с железом.
Показано, что с понижением температуры вероятность реакций возрастает. В интервале температур 200+600 К реакции алюминия и кремния с водой и при 300+1000 К с водяным паром идут до конца. Железо с водой в интервале температур 300+600 К реагирует с полнотой реакции αтеор.=1. При взаимодействии железа с водяным паром в интервале 300+1000 К αтеор. изменяется от единицы до 0,72. Увеличение давления до 15 МПа практически не влияет на выход водорода.
Расчетами показана возможность получения водорода высокой чистоты. Это же было подтверждено экспериментами [181].

