ИСХОДНЫЕ КОМПОНЕНТЫ ДЛЯ КЕРАМИЧЕСКИХ ДИЭЛЕКТРИКОВ
ОБЩИЕ СВЕДЕНИЯ ОБ ИСХОДНЫХ КОМПОНЕНТАХ
Для получения высокоплотной керамики необходимо, чтобы исходные компоненты имели достаточно малый размер частиц, нс более нескольких микрон, и содержали лишь допустимые в соответствии с поставленной задачей примеси.
В настоящее время изготовители могут купить порошок ВаТiO2 или BaTiO3 + CaSnO3 (это конденсаторный материал, см. рис. 7-3-1), полученный предварительным обжигом исходных компонентов.
ПОДРОБНЫЕ СВЕДЕНИЯ ОБ ИСХОДНЫХ КОМПОНЕНТАХ
Ниже будут рассмотрены основные исходные материалы для керамических диэлектриков.
Карбонат бария (ВаСОз) — токсичный белый порошок, плотность которого равна 4,43 г/см3, молекулярная масса — 197,37. При комнатной температуре имеет ромбическую структуру (γ-форма), изоморфен арагониту. Постоянные решетки α0=0,5314, b0=0,8904, с0=0,643О нм. Выше температуры 811°С устойчива гексагональная структура (β-φορма), а выше 982°С устойчивой становится тетрагональная структура. Температура плавления равна 1360°С, при температуре 1450°С разлагается.
Углекислый барий трудно растворим в воде. Растворимость в 100 г холодной воды 2,2 мг, в 100 г горячей воды — примерно 6,5 мг, т. е. немногим больше, чем у СаСО3 и SrCO3.
BaCO2 растворяется в соляной кислоте с образованием ВаСl2. Медики при рентгеноскопии желудка применяют так называемый «барий», т. е. сернокислый барий (BaSO/,). который почти не растворяется ни в поде (при температуре 18°С в 100 г воды растворяется 0,22 мг), ни в кислотах и потому его введение в человеческий организм безвредно. Напротив, BaCO3 в определенной степени растворяется даже в желудочных кислотах, поэтому существует большая опасность отравления. Этим, по-видимому, объясняется японское название природного минерала витерита (ВаСO3): «ядовитый тяжелый камень».

Рис. 2-2-1. Схема изготовления ВаСO3.
Природный минерал витерит (ВаСО3) добывают в небольших количествах, поэтому для потребностей промышленности углекислый барий получают из барита (BaSO4).
В Японии 96%-ный барит получают на о. Хоккайдо. Годовое производство в конце 60-х годов составляло 20000 т., что удовлетворяло потребности страны в бариевых материалах примерно на 60%. Для получения карбоната бария барит обжигают с антрацитом при температуре 600—800°С, при этом по реакции
![]() (2-2-1)
(2-2-1)
образуется сульфид бария — BaS.
Его извлекают горячей водой и в полученный раствор вводят соду, прошедшую операции растворения, очистки и фильтрации. В результате реакции
![]()
(2-2-2)
образующийся углекислый барий выпадает в осадок. Осадок промывают водой, отфильтровывают, сушат, измельчают, взвешивают, упаковывают и получают готовый продукт (рис. 2-2-1). В табл. 2-2-1 приведены результаты стандартного анализа углекислого бария, имеющегося в продаже. Углекислый барий, предназначенный для оптического стекла, служит для повышения коэффициента преломления и понижения температуры плавления, придавая стеклу блеск и улучшая рассеяние света. Для оптического стекла нужен самый чистый продукт. Если необходима высокая чистота диэлектрика или феррита, то можно использовать этот сорт, по стоимость его значительно выше. Для обычных керамических конденсаторов вполне пригоден «обычный» углекислый барий.
Двуокись титана (TiOz) получают из трех природных минералов: рутила, анатаза и брукита, из которых наиболее распространен первый. Природная двуокись титана часто окрашена из-за присутствия окислов
железа, в чистом виде бесцветна. Титан в небольших количествах широко распространен в природе. Средняя концентрация титана в почве превышает 0,5%. В железных рудах содержится довольно большое количество двуокиси титана, например в виде минерала ильменита. Кроме того, существуют такие титаносодержащие минералы, как перовскит, титанит и др.
Таблица 2-1-1

Кристаллическая структура и физические свойства в видимой области имеет близкий к единице коэффициент отражения и поэтому обладает высокой белизной и блеском. Окрашивающая способность двуокиси титана значительно выше, у таких белых пигментов, как цинковые и свинцовые белила.
Таблица 2.2.
Химический состав, %, ильменитовых руд различных месторождений

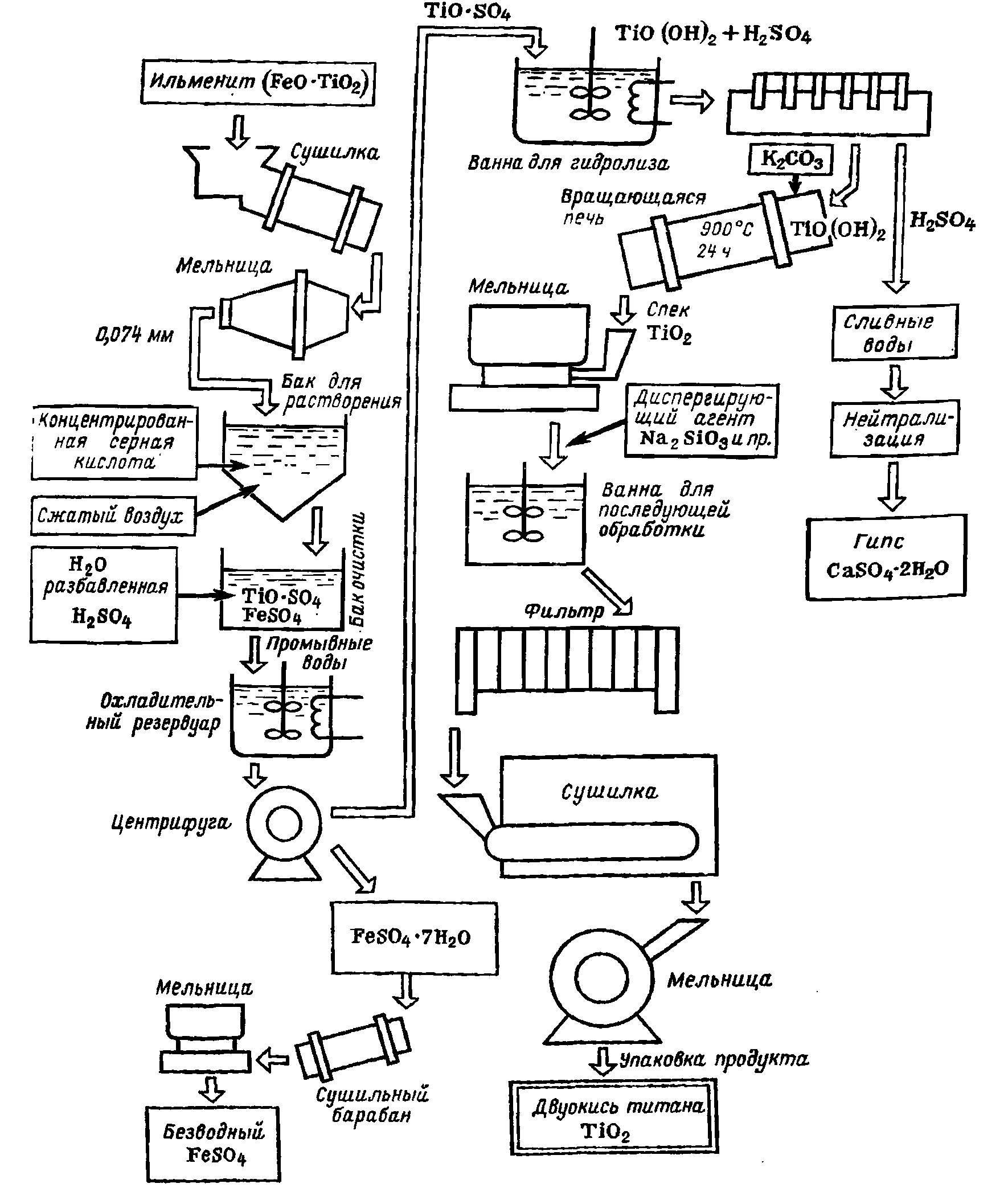
Рис. 2-2-2. Схема изготовления двуокиси титана.
В качестве сырья часто применяют ильменит из месторождений Австралии, Малайзии и др. (табл. 2-2-2). Ниже последовательно рассмотрен один из процессов изготовления двуокиси титана из указанного сырья (рис. 2-2-2).
Сушка и измельчение. Ильменит обычно содержит примерно 2% воды, поэтому его сушат во вращающихся сушилках до влажности 0,5%, затем измельчают в шаровых мельницах стальными шарами до размера частиц менее 0,074 мм.
Растворение. В бак для растворения подают заданное количество 85 95%-ной серной кислоты, включают воздушный барботаж и но возможности быстро вносят отвешенное количество ильменита. Пропусканием острого пара повышают температуру до 110 С, при этом начинается реакция между серной кислотой и ильменитом:
![]() (2-2-3)
(2-2-3)
За счет тепла реакции температура быстро повышается и процесс заканчивается через 5—20 мин. Продукты реакции образуют нерастворимый шлам плотное, по легко крошащееся твердое тело серого цвета, состоящее главным образом из сернистого титанила, сульфатов двухвалентного и трехвалентного железа и силикатов. Чтобы облегчить последующее растворение, во время реакции через вязкую массу продувают воздух и получают продукт в форме пчелиных сот.
Если использовать примерно 70%-ную серную кислоту, то продукты реакции не схватываются и остаются вязкими после завершения реакции. Но при этом потребляется примерно в 1,5 раза больше серной кислоты. Для растворения продукты реакции переносят в бак очистки, подают туда воду, разбавленную серную кислоту и сжатый воздух. При такой технологии растворения необходимо, чтобы ионы железа в растворе были в двухвалентном состоянии. С этой целью в бак добавляют восстановители, например железные опилки. После этого вводят желатину, сульфид сурьмы или другие коагуляторы, при этом шлам и непрореагировавшие материалы осаждаются. Затем для удаления остатков шлама вводят небольшое количество инфузорной земли в качестве материала, способствующего фильтрации, после чего жидкость пропускают через фильтр из пористого карборунда.
Отделение кристаллов железного купороса. Фильтрат переносят в охладительный резервуар, где при пониженной температуре выпадают кристаллы FeSO4, 7Η2O. (Растворимость этих кристаллов зависит от содержания ТiO2 и концентрации H2SO4 в растворе.) Кристаллы отделяют от раствора на центрифуге, затем высушивают в сушилке и продают в качестве побочного продукта.
Гидролиз. Раствор, оставшийся после очистки, фильтрации и кристаллизации, упаривают в вакуумном выпарном аппарате непрерывного действия. При этом происходит гидролиз по реакции
![]() (2-2-4)
(2-2-4)
Следует иметь в виду, что если концентрация ТiO2 и соотношение H2SO4 и ТiO2 в первоначальном растворе нe оптимальны, то это повлияет отрицательно на распределение частиц продукта по размере. При гидролизе в раствор в качестве затравки вносят анатаз или рутил в количестве примерно 1 % массы двуокиси титана. Зародыши из анатаза изготавливают по методу Мекленбурга или Блюменфельда.
Выпавший осадок отфильтровывают, промывают, снижая содержание Na2SO4, измельчают и затем, поддерживая концентрацию ТiO2, равную 100-110 г/л, вводят ч качестве зародышей в гидролизуемый раствор. При нагревании и перемешивании этого раствора в осадок выпадает метатитановая кислота.
Фильтрация, промывка и обжиг. Осадок метатитановой кислоты отфильтровывают. Чтобы в процессе фильтрации двухвалентное железо не окислялось и не выпало в осадок, поддерживают концентрацию серной кислоты не выше 10—20 г/л и, кроме того, вводят металлический цинк или трехвалентный ион титана. К коржам, снимаемым с фильтра, добавляют К2СО3 в качестве регулирующего агента и в случае анатаза обжигают при температурах 900—1000°С в течение примерно 24 ч. При этом происходит реакция:
![]() (2-2-5)
(2-2-5)
Если не вводить К2СО3, то во время последующего обжига происходит сплавление продукта в прочный монолит, что затрудняет измельчение. С другой стороны, если понизить температуру обжига, то ухудшаются пигментные свойства, для улучшения пигментных свойств добавляют фосфаты, а для улучшения светостойкости вводят Sb2О3. В процессе обжига полученные при гидролизе частицы размером примерно 0,02 мкм увеличиваются до 0,2-0,3 мкм.
Последующая обработка. После обжига проводят различного рода дополнительную обработку. Прокаленная двуокись титана представляет собой материал в виде кусков (клинкер), которые измельчают сухим или мокрым способом, затем в качестве диспергирующего агента добавляют каустическую соду, силикат натрия, фосфат натрия или другие материалы и методом отмучивания удаляют зерна размером более 4 б мкм. Отмучивание может происходить в неподвижной жидкости и в потоке. Для этой цели часто применяют горизонтальную центрифугу. При ее использовании количество воды в суспензии должно по меньшей мере в 7 раз превышать количество, в противном случае сепарация будет неэффективна. После отмучивания, добавляя коагулянт, получают осадок, нейтрализуют щелочью до pH = 7 и осадок отфильтровывают, промывают, сушат, измельчают, упаковывают и получают продукт общего назначения. ТiО2 применяется в качестве белого пигмента в производстве малярных и художественных красок, резиновых изделий, бумажных изделий, типографской краски, синтетических смол, эмалей, кроме того, для получения конденсаторов. По статистике 1966 г. в Японии было произведено 110 тыс. т двуокиси титана. Хотя можно утверждать, что в последнее время количество двуокиси титана, идущее на производство конденсаторов, увеличивается, однако оно не превышает 1% общего расхода этого продукта. Указанный способ изготовления двуокиси титана ориентирован главным образом на потребности красочного производства. Для электронной промышленности желателен был бы химически чистый продукт, при изготовлении которого обходились бы без введения калия и натрия.
Двуокись циркония (ZrO2). Цирконии был впервые обнаружен в виде двуокиси циркония, полученной из минерала циркона (ZrSO4) с о. Цейлон.
Наиболее важный для промышленности минерал бадделеит, но месторождения его ограничены югом Бразилии.
Состав, %, двуокиси циркония, по данным фирмы „Син ниппон кинсоку кагаку"

В настоящее время для изготовления двуокиси циркония используют так называемый «мокрый» способ, при котором циркон обрабатывают каустической содой. Полученный цирконат натрия растворяют в соляной кислоте, образующийся хлористый цирконий (ZrОCl2-8H2О очищают. Ниже кратко описан процесс изготовления ZrО2.
Двуокись олова (SnО2) в природе встречается в виде оловянного камня (кассетерита). Кристаллы его относятся к тетрагональной структуре, в чистом виде должны быть бесцветны. Однако большей частью краска черная или темно-коричневая из-за наличия примесей железа. Плотность равна 6,95 г/см3, температура плавления выше 1900°С (выше 500°С повышается давление паров).
В недалеком прошлом двуокись олова в большом количестве применяли для получения белых непрозрачных керамических глазурей. Для этой цели SnО2 получали обжигом на воздухе металлического олова (непосредственно оловянный камень не использовали из-за присутствия в нем вредных примесей). Существуют три кристаллические структуры двуокиси олова: упоминавшаяся выше тетрагональная, а также ромбическая и гексагональная. Кроме того, имеется аморфная двуокись олова. которая образуется при гидролизе гидроокиси олова. Таким образом, SnО2 существует в четырех модификациях, что необходимо учитывать при выборе исходных компонентов.
Следует подчеркнуть, что двуокись олова, необходимая для получения материалов электронной техники, в отличие от идущей в традиционную керамическую промышленность не должна содержать грубых зерен и металлических примесей.
Углекислый кальций (СаСОз) в природе встречается в виде известняка, кальцита, арагонита. Кальцит имеет гексагональную структуру, арагонит — ромбическую. Известняк непосредственно используется в качестве сырья для керамической промышленности. То, что называют «осажденным углекислым кальцием», получают в виде тяжелого белого порошка путем введения карбонатов щелочных металлов в раствор, содержащий растворимые соли кальция.
Плотность гексагональной модификации равна 2,711 г/см3, ромбической— 2,93 г/см3. Обе эти формы при температуре 825°С разлагаются. Растворимость в 100 г холодной воды—1,5 мг. горячей — примерно 1,9 мг.
Окись магния (MgO) образует бесцветные кристаллы тетрагональной структуры, которые имеют плотность 3,65—3,75 г/см3, коэффициент преломления 1,736, температуру плавления 2800°С. В 100 г холодной воды растворяется лишь 0,6 мг MgO. Она хорошо растворяется в кислотах и аммонийных солях. Минерал MgO называют периклазом (см. рис. 9-3-1), в нем обычно присутствует небольшое количество (Ре, Μη, Zn) О, образующего с MgO твердый раствор. В качестве промышленного сырья используют окись магния, полученную сжиганием металлического магния или термическим разложением магнезита (MgCO3). Если MgO получают разложением Mg (ОН) г, то его необходимо предварительно обжечь при температуре 1400— 1500°С или выше. В противном случае образуется неустойчивая кристаллическая структура. При нагревании MgO до высокой температуры в электропечах происходит возгонка и из газовой фазы выделяются кристаллы, химически очень устойчивые. Поэтому из MgO в больших количествах изготовляют огнеупоры и тигли.
Двуокись кремния (SiO2). Безводная кремнекислота, или кремнезем, кристаллизуется в виде кварца или обладающего нечеткой поверхностью агата. Кварц широко и в больших количествах встречается в породах и россыпях в виде зерен, песка, порошка. Однако самым чистым из них является песок, служащий важнейшим кварцевым сырьем. Особенно крупные кристаллы кварца представляют собой горный хрусталь. Обычно кремнезем имеет форму кварца, по существуют еще две модификации — тридимит и кристобалит (см. рис. 9-3-1), которые в свою очередь при тщательном анализе можно подразделить на а- и β-фор.мы. Температуры перехода из одной модификации в другую показаны ниже.

Соединения редкоземельных элементов. Это важные исходные компоненты для керамических материалов современной электронной техники. Используют соединения лантана, церия, неодима, иттрия. На рис. 2-2-3 показана схема их разделения.
1) Окись лантана (Lа2Оз). В последнее время в качестве исходного компонента для изготовления конденсаторов, служащих для температурной компенсации, широко используют Lа2O3-2ТiO2 (см. подпараграф 7-2-1). Кроме того, изготавливают полупроводниковый ВаТiO3, модифицированный малыми добавками Lа2O3, предназначенный для терморезисторов с положительным температурным коэффициентом сопротивления (см. подпараграф 9-1-1). В табл. 2-2-4 приведен пример химического состава различных марок окиси лантана, имеющихся в продаже. Из суммарных затрат на приобретение всех окислов редкоземельных элементов для изготовления конденсаторов на долю окиси лантана приходится 70%.
T а б л и ц а 2-2-4
Химический состав, % различных марок La2O3 по техническим данным фирмы „Син Ниппон кинсоку кагаку“


Рис. 2-2-3. Схема разделения окислов редкоземельных элементов: СеО2, Lа2O3 и Nd3O3 (технические данные «Син ниппон кинсоку кагаку»).
Кристаллическая структура La2O3 гексагональная, плотность равна 6,51 г/см2 3, теплоемкость — 313 Дж/(кг-К), коэффициент преломления n= 1,77, диэлектрическая проницаемость 1,75, температура плавления 2315±25°С. Порошок La2O3 чисто-белого цвета. Щелочные свойства La2О3 выражены ярче, чем у Се2O3 Рг2O3 и Nd2О3, и примерно соответствуют МН4ОН.
Окись лантана легко адсорбирует воду и углекислый газ из воздуха и даже при комнатной температуре превращается в карбонат лантана,
Окись церия (СеО2) кристаллизуется в терагональной структуре типа флюорита; теоретическая плотность ее 7,18 г/см3, температура плавления 1950°С, теплоемкость 324 Дж/(кг-К), порошок желтоватобелого цвета. В окиси церий всегда четырехвалентный.
где присутствуют Се34·, при выдержке на воздухе образуется Се4+. В отличие от других окислов редкоземельных элементов СеО2 плохо растворяется в кислотах. Окись церия в последнее время используется как микродобавка к полупроводниковому ВаТiO3. Как видно из рис. 2-2-3, двуокись церия СеО2-100, полученная обжигом оксалата церия, имеет большую степень чистоты, чем СеО2-90, полученная обжигом гидроокиси церия.
Хранение исходных компонентов. Основные сырьевые материалы для традиционной керамики, например глина, полевой шпат, кремнезем, каолин, используют непосредственно в таком виде, в каком их добывают в карьерах, т. е. с большим количеством загрязнений. В противоположность этому основные исходные компоненты, предназначенные для керамических диэлектриков, например для керамики на основе ВаТiO3 или ТiO3, представляют собой химические реактивы высокой чистоты и безусловно при их хранении следует соблюдать особую осторожность. Основные рекомендации для получения изделий высокого качества заключаются в следующем.
- Емкости для хранения исходных компонентов должны быть такими, чтобы в них не проникали загрязнения. Для каждого исходного компонента должны быть свои лопатки, совки и другие приспособления, необходимые для взвешивания.
- В складские помещения для исходных компонентов не должна проникать пыль. Кроме того, необходимо особенно тщательно следить за гем, чтобы исходные компоненты не намокали.
- Каждый из исходных компонентов, идущих на изготовление данной партии, должен быть одного сорта, поставляться одним изготовителем. Для каждой партии исходного компонента должны быть известны предыстория, а также изготовитель, дата изготовления, стандарт.

