Химическое взаимодействие натрия и воды может сопровождаться повышением давления и температуры. Для иллюстрации этого положения в качестве примера на рис. 2.2 представлены результаты расчета них параметров при взаимодействии натрия с различными количествами воды [20]. В расчетах предполагалось, что реакция полностью завершается в жестком контейнере с заданными условиями его взаимодействия с внешней средой; образующийся водород занимает объем, возникающий вследствие разности объемов реагентов и конечных продуктов.
Замечено, что процесс взаимодействия натрия и воды при истечении одного реагента в другой в свободном объеме сопровождается пульсацией давления в зоне реакции [20].
В работе [21] специально исследовалась природа подобного явления. Исходили из предположения, что причиной скачкообразного повышения давления могут быть гидродинамические эффекты истечения струи воды под давлением; эффекты быстрого испарения воды при попадании ее из области высокого давления в натрий с низким давлением и высокой температурой; неравномерный характер самой реакции взаимодействия из-за изменения площади контакта реагентов.
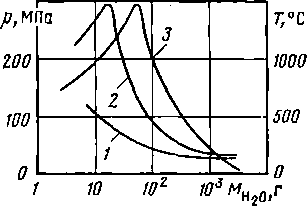
Рис. 2. 2. Изменения давления и температуры при взаимодействии одного моля натрия с различным количеством поды:
1 — давление при изотермической реакции; 2 - давление при принятии справедливости законов идеального газа; 3 - температура при адиабатических условиях
Путем исключения одновременного действия перечисленных выше факторов (впрыска воды в холодную воду, в газ и органическую жидкость при высокой температуре, в расплавленный натрий) экспериментально было доказано, что скачкообразный рост давления вызван именно реакцией взаимодействия.
Поскольку одним из продуктов реакции является водород, то Кинг [20] высказал предположение о влиянии последнего на перемешивание реагентов. Меняя начальное давление реагентов в диапазоне 0-1,5 МПа (тем самым изменяя объем газовой фазы), Кинг заметил различие в интенсивностях реакций.
Кинг исследовал также влияние начальной температуры на характер реакции [20]. При смешивании сплава натрий-калий с водой при комнатной температуре реакция проходила так бурно, что наблюдалось разрушение бака, ранее испытанного на давление 20 МПа. При предварительном прогреве сплава натрий-калий до 320 °C реакция его с водой происходила без каких-либо резких скачков давления.
Исследование взаимодействия щелочных металлов (в том числе и натрия) с водяным паром показало более спокойный и безопасный характер реакции по сравнению с взаимодействием их с водой.
При впрыске расплавленного натрия в воду, находящуюся при комнатной температуре, замечены более интенсивные динамические эффекты по сравнению с эффектами при впрыске воды в расплавленный натрий [21].
Это явление можно объяснить, используя данные Кинга о влиянии начальной температуры среды, в которой происходит взаимодействие.
Действительно, при введении натрия в воду температура избыточной среды составляла всего 20—40 °C по сравнению со 170-240 °C при впрыске воды в натрий. В первом случае фазовое превращение гидроксида натрия наступило позднее, что усилило неравномерность реакции.

