К категории аккумуляторов химической энергии следует отнести такие, которые позволяют запасать и отдавать энергию в результате химических реакций. При этом запасенная энергия может выделяться в виде теплоты, электроэнергии, света и механической энергии. Чаще всего основной реакцией, выделяющей энергию, является реакция окисления. Аккумуляторы могут содержать в своем составе как окисляемое вещество, так и окислитель. В некоторых случаях в качестве окислителя используется кислород воздуха.
Все природные органические топлива (уголь, нефть, природный газ и т. п.) по существу являются аккумуляторами химической энергии. Они используются, как правило, с воздушным окислителем, и поэтому их удельные характеристики оцениваются в расчете только на само горючее. При этом удельная энергия лучших природных топлив может достигать 45 000 кДж/кг. Если же эти топлива использовать, например, в условиях космоса, когда окислитель тоже надо включать в общую массу топлива, то удельные характеристики оказываются значительно ниже. Действительно, для полного сгорания 1 кг бензина или керосина необходимо около 3 кг кислорода, следовательно, общая масса топлива в расчете на 1 кг горючего окажется равной 4 кг, и максимальная удельная энергия составит только 10 000 кДж/кг.
Природные топлива как аккумуляторы энергии обладают большим числом привлекательных свойств, к которым относятся возможность длительного, практически неограниченного хранения, высокие скорости энерговыделения после начального инициирования, высокая удельная и объемная энергия, относительно малая токсичность продуктов сгорания и многие другие свойства.
Наряду с природными органическими топливами в ряде случаев уже теперь, а впоследствии во все возрастающем количестве, люди будут использовать в качестве аккумуляторов энергии искусственные топлива как органические, так и неорганические. Под таким искусственным топливом, или энергоносителем, следует понимать любое вещество или ряд веществ, которые вступая в реакцию друг с другом или с веществами, находящимися в окружающей среде, обычно в неограниченных количествах (воздух, вода, иногда углекислота), могут выделять энергию. В ряде случаев продукты этих реакций должны иметь возможность вновь регенерироваться, т. е. превращаться в исходные вещества при затрате необходимых количеств энергии. Такие искусственные топлива должны рассматриваться именно как аккумуляторы энергии и, тем самым, принципиально, могут отдать меньше энергии, чем затрачивается на их приготовление.
Общая схема такого химического аккумулятора энергии представлена на рис. 6.2. За счет какого-либо источника энергии 1, не являющегося в общем случае органическим топливом1, в химическом реакторе 2 производится энергоноситель. С этой целью в реактор подаются некоторые вещества из окружающей среды и вещества, являющиеся продуктами использования энергоносителя. Кроме энергоносителя в реакторе могут производиться и побочные продукты, часть из которых может считаться полезной, а часть — сбрасывается в окружающую среду. Энергоноситель затем может транспортироваться к потребителю 3 на достаточно большое расстояние, где его химическая энергия превращается в нужный потребителю вид энергии. Для осуществления указанного преобразования энергии могут использоваться Дополнительные вещества из окружающей среды. Продукты реакции могут либо возвращаться на регенерацию, либо сбрасываться в окружающую среду.
1В частном случае роль источника энергии при производстве химического энергоносителя может выполнять уголь, непосредственное использование которого некоторыми потребителями нецелесообразно.
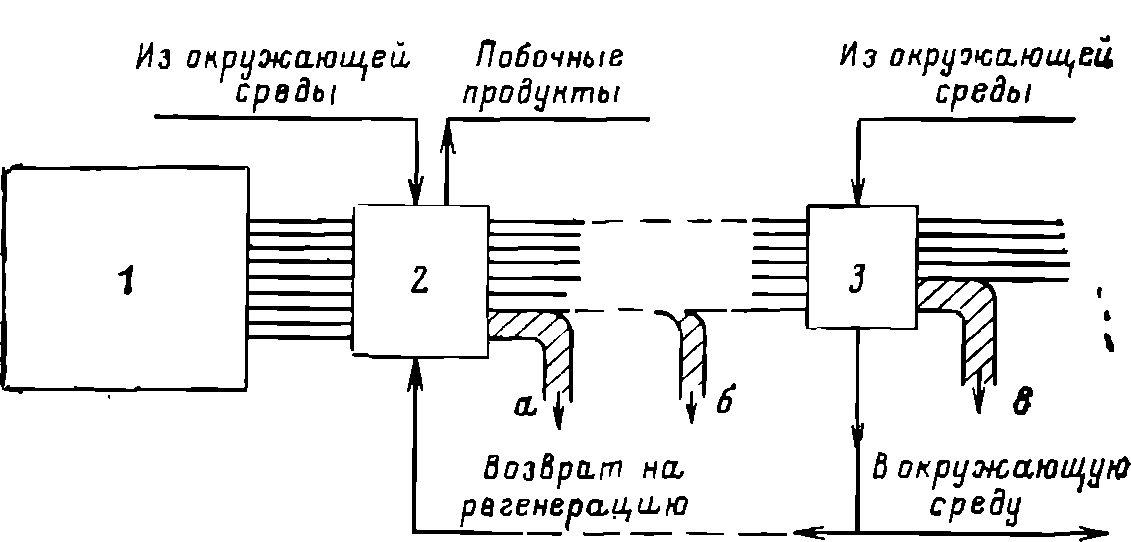
Рис. 6.2. Принципиальная схема получения и использования искусственного энергоносителя.
Во всех случаях по потокам вещества рассматриваемая схема должна быть замкнутой, ио иногда замыкание может осуществляться не непосредственно, а через окружающую среду. Если например, одним из продуктов реакции у потребителя 3 явится вода, то возвращать ее в реактор 2 при больших расстояниях окажется нецелесообразным — в том месте, где установлен реактор 2, свежую воду надо будет черпать из окружающей среды. Если же расстояния невелики, то цикл целесообразно замкнуть и по воде. То же, хотя и не в полной мере, может относиться к углекислоте.
По потокам энергии схема, разумеется, не замкнута. Полезный поток энергии на рис. 6.2 показан горизонтальной штриховкой. Косой штриховкой показаны неминуемые потери: а — при производстве энергоносителя, б — при его транспорте и в — при преобразовании энергии у потребителя.
В качестве энергоносителей — аккумуляторов энергии могут рассматриваться как органические, так и неорганические вещества. Основные реакции, освобождающие энергию, запасенную в энергоносителе,— сжигание в воздухе или кислороде, или реакция с водой с образованием теплоты и водорода, который оказывается вторичным энергоносителем и далее либо сжигается, либо используется в топливном элементе.
В ряду возможных энергоносителей собственно водороду сейчас уделяется очень большое внимание. Он обладает рядом интересных свойств, позволяющих рассчитывать на его широкое применение. Прежде всего необходимо отметить очень высокую теплоту сгорания водорода, которая составляет около 117 000 кДж на 1 кг водорода. Далее — при сжигании водорода образуется только водяной пар (при сжигании в воздухе возможно образование некоторого количества окислов азота), безвредный для окружающей среды и не требующий возвращения каких-либо продуктов на регенерацию. Наконец, водород является не только энергоносителем, но и веществом, имеющим большое значение для органического синтеза и могущим применяться в металлургии для прямого восстановления металлов из руд.
Недостатком водорода является то, что это трудно- сжижаемый газ. Газообразный энергоноситель неудобен для транспортных установок, особенно если учесть, что плотность водорода при нормальных условиях очень мала (0,09 кг/м3). А для сжижения водорода необходимы очень низкие температуры (—252°С). Ясно, что сжижение водорода требует больших затрат энергии, а сохранение его в жидком виде — применения достаточно сложных и дорогих криостатов.
Наряду с водородом в качестве энергоносителей сегодня рассматриваются аммиак и метанол (метиловый спирт) и некоторые другие органические вещества. Эти вещества могут быть синтезированы с помощью водорода и имеют перед ним то преимущество, что при обычных условиях или близких к ним представляют жидкости. Однако их удельные энергии существенно ниже, чем у водорода: у аммиака около 16 700 кДж/кг, а у метанола около 20 000 кДж/кг. Кроме того, при их сжигании наряду с водяными парами образуются окислы азота и углерода, загрязняющие атмосферу.
В связи со схемой на рис. 6.2 отмечалось, что роль источника энергии при производстве энергоносителей может играть уголь. При переработке угля могут получаться и энергоносители, рассмотренные выше, и более сложные органические вещества, жидкие и твердые, близкие по составам к существующим топливам и обладающие как их преимуществами, так и недостатками.
На ближайшую перспективу получение из дешевых углей Канско-Ачинского бассейна искусственных жидких топлив представляет собой важнейшую задачу для нашей страны.
Наконец, несколько особняком в ряду возможных энергоносителей стоят металлы. Металлы достаточно распространены в природе, однако в силу их высокой химической активности, за редким исключением (золото, платина), не встречаются в чистом виде, а чаще всего в виде соединений — окислов, гидроокисей, солей и т. п. Все эти соединения достаточно прочные и для их разрушения — для получения металлов в чистом виде — необходимо затрачивать довольно много энергии. Но после того, как чистый металл получен, его можно рассматривать как энергоноситель, ибо при его реакции с кислородом, водой или еще каким-нибудь веществом можно получить энергию в виде теплоты или в виде водорода. В ряду таких металлических энергоносителей особенно интересны магний, кальций, алюминий и кремний. Вопрос об их использовании — сжигании или реакциях с водой — нельзя пока считать решенным для практического применения, однако в этом направлении ведутся поисковые работы.
Говоря об энергоносителях, необходимо принимать во внимание, как к. п. д. процесса преобразования энергии, так и капиталоемкость, т. е. исходить из расчетных затрат на производство единицы энергии в виде данного энергоносителя.
Особый класс химических аккумуляторов энергии представляют электрохимические аккумуляторы. В них в результате химической реакции энергия получается непосредственно в виде электроэнергии, иногда дополняемой некоторым количеством теплоты. Для инициирования реакции в таком аккумуляторе достаточно замкнуть внешнюю электрическую цепь.
Электрохимические аккумуляторы бывают обратимыми и необратимыми. В первом случае, если к аккумулятору подводить электроэнергию извне, химическая реакция в нем идет в обратном, направлении, в результате чего аккумулятор, как принято говорить, заряжается.
Обратимые электрохимические аккумуляторы сегодня широко распространены. Они используются прежде всего для запуска двигателей внутреннего сгорания. Во время работы двигателя аккумуляторы подзаряжаются,
находясь всегда в состоянии готовности. Электрохимические аккумуляторы характеризуют обычно емкостью, выраженной в ампер-часах. Так как каждой электрохимической реакции соответствует определенная разность потенциалов, то задание емкости по существу характеризует энергию, запасаемую аккумулятором.
Так, например, если автомобильный стартерный аккумулятор имеет емкость 50 А-ч при напряжении 12 В, то это означает, что энергия, аккумулированная в нем, составляет Еак=50·12-3600·10-3=2160 кДж.
Наиболее распространен в настоящее время свинцово-кислотный аккумулятор, в котором протекает реакция![]()
Когда аккумулятор отдает энергию, реакция в нем идет слева направо, а когда заряжается — справа налево.
Свинцово-кислотные аккумуляторы сравнительно дешевы и достаточно долговечны, но обладают низкими удельными значениями энергии — менее 100 кДж/кг. Удельную энергию до 400 кДж/кг имеют более дорогие серебряно-кадмиевые аккумуляторы.
Высокая стоимость и низкие удельные энергии лучших электрохимических аккумуляторов препятствуют их широкому внедрению в транспортные установки в качестве основного источника энергии. Электромобили на аккумуляторах пока являются недостаточно рентабельными и могут применяться только в специфических условиях.
Необратимые электрохимические аккумуляторы обладают достаточно высокими удельными характеристиками, но, так как они могут быть использованы только однократно, определяющей оказывается их сравнительно высокая начальная стоимость. Поэтому такие аккумуляторы применяются только как малые источники электроэнергии для радиоаппаратуры, переносных осветительных приборов и т. п.

