Вернемся снова к источнику энергии тепловых электростанций — к топливу. Во всех вышеописанных способах генерации электроэнергии топливо сжигалось; его внутренняя (химическая) энергия превращалась в тепло, которое дальше преобразовывалось в электроэнергию прямо или косвенно. Нельзя ли научиться использовать энергию топлива, не сжигая его? Заманчива мысль получать электрическую энергию прямым преобразованием химической энергии топлива, минуя превращения этой химической энергии в тепловую. При этом мы избегаем удручающе невыгодного процесса обратного преобразования теплоты в механическую энергию.
Можно ли это сделать? В принципе можно. Для этого нужно заменить сжигание топлива его окислением в гальванических элементах. До сих пор гальванические элементы не давали возможности непосредственно преобразовать энергию топлива в электроэнергию, так как в гальванических элементах использовалось не природное топливо, а различные металлы и другие химические вещества.
По существу идея «топливного элемента» сводится к следующему. Процесс горения — это химическая реакция окисления горючего, сопровождающаяся выделением большого количества энергии в виде тепла. Другие химические реакции, идущие с выделением энергии, как, например, растворение цинка в серной кислоте, давно используются для получения электрического тока в гальванических элементах. Это возможно потому, что при подобных химических реакциях происходит переход электронов от атомов одних веществ к другим. Чтобы энергия, освобождающаяся при таких электронных переходах, превращалась в работу электрического тока, а не в тепло, нужно заставить электроны переходить не непосредственно от одних реагирующих атомов к другим, а сначала пройти обходный путь через электроды, введенные в зону реакции, и внешнюю электрическую цепь; в последней они должны отдать освобождаемую энергию. Это и происходит в гальванических элементах, включенных в замкнутую цепь.
Аналогичным образом нужно организовать и реакцию горения. В качестве примера рассмотрим процесс «сгорания» водорода в кислороде, проведенный таким образом. Этот процесс распадается на следующие ступени. С одной стороны, молекулы водорода расщепляются каждая, на два отдельных атома и они ионизуются, причем освобождаются два электрона: Н2 → 2Н++2е. Их нельзя пустить сразу перейти к атомам кислорода. Нужно заставить их предварительно выделиться на аноде элемента и пройти через внешнюю электрическую цепь к другому электроду. Здесь атом кислорода, составляющий половину молекулы кислорода, получает 2 электрона, пришедшие из внешней цепи и превращающие этот атом в отрицательный ион кислорода:
![]()
Ионы![]() в одном растворе образуют с молекулами воды отрицательные гидроксильные ионы:
в одном растворе образуют с молекулами воды отрицательные гидроксильные ионы:
![]()
Наконец, большая часть ионов водорода Н + и гидроксилов ОН-, образовавшихся при этом процессе, соединяются в молекулы воды:
![]()
Непосредственное горение смеси Н и О приводит к выделению 137 килокалорий тепла на 1 моль2 (т. е. грамм-молекулу) сгоревшего водорода. А при проведении этого процесса в гальванической цепи можно теоретически получить работу, эквивалентную 113 килокалориям. Это дало бы к. п. д. в 83%.
При использовании энергии угля идет другой процесс—соединение углерода с кислородом. Атом углерода должен отдать 4 электрона во внешнюю цепь: С → С++++ + 4е. С помощью этих электронов два атома кислорода превращаются в 2 отрицательных иона: О2 + 4е→2О_ которые в воде образуют 4 гидроксильных иона: 2О— + 2Н2О→4ОН—. В действительности процесс происходит несколько сложнее, так как он практически должен проводиться при участии других веществ, например едкого натра. Тогда в целом реакция выглядит так:
С + О2 + 2Н2О +2NaOH - Na2CO3 + 3H2O.
Каков же энергетический баланс этой реакции? Тепловой эффект реакции сгорания углерода при температуре в 25°С равен 94 килокалориям на моль. Максимальная работа, которую можно получить от этой реакции (в частности, это относится и к работе в гальваническом элементе), может составить тоже 94 килокалории на моль. К. п. д здесь теоретически 100%! При этом ожидается э. д. с. 1,02 в. Если просмотреть таким же путем другие реакции горения (например, 2СО + О2 →2СО2), то мы встретимся здесь с теоретическими значениями к. п. д., превышающими 100%. Это может на неподготовленного читателя произвести впечатление мистификации. Но на самом деле все это вполне серьезно. Понимать это нужно так: энергетический выход выше 100% указывает, что помимо тепла, освобождаемого в самом процессе, здесь еще отбирается и используется тепло от окружающей среды. Это так называемая эндотермическая реакция. Такие реакции, если их произвести в гальваническом элементе, могут привести к тому, что даже часть тепла окружающей среды перейдет в электроэнергию.
2 Моль — сокращенное название грамм-молекулы, т. е. количества данного вещества, содержащего столько граммов, сколько единиц в его молекулярном весе.
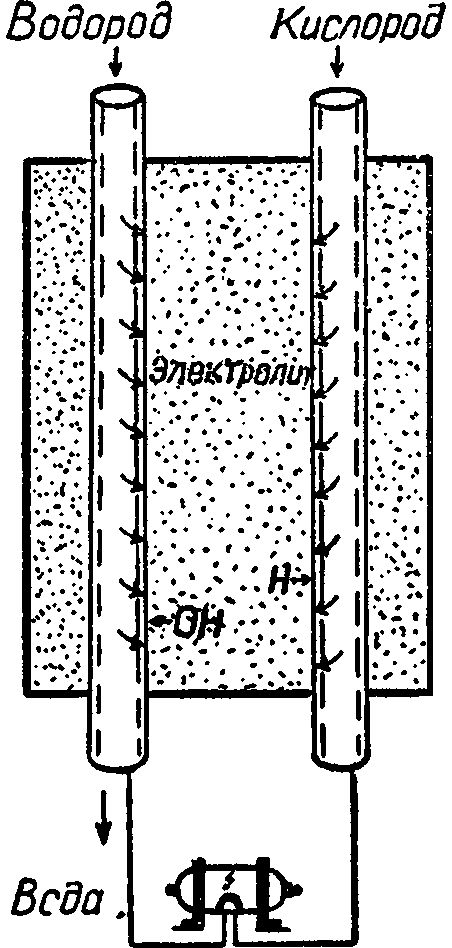
Рис. 13. Схема топливного элемента.
Принципиальная схема такого топливного элемента показана на рис. 13. В сосуд с электролитом, например с раствором щелочи, введены две пористые трубки из электропроводных материалов. Через одну пропускается горючее — водород или какой-либо углеводород, через другую — кислород. Эти же трубки служат электродами, и к ним присоединяется внешняя цепь.
В действительности устройство топливных элементов гораздо сложнее. Сжигание даже газообразного топлива в гальваническом элементе — задача далеко нелегкая; она требует подбора подходящих условий (давления и температуры газов, состава электролита, материала и структуры трубок — электродов и т. д.). Она становится еще сложнее, если нужно сжигать твердое топливо — уголь, так как реакция окисления углерода даже при температуре 200—300°С идет крайне медленно. Приходится переходить к температурам порядка 700— 800°С и применению веществ, ускоряющих реакцию (катализаторов). В результате упорной работы, начавшейся еще в прошлом веке в разных странах, разработаны опытные образцы топливных элементов и батарей; мощность их уже достаточна для ряда практических задач, хотя еще далека от промышленной энергетики.
В Англии Бэконом изготовлены элементы, в которых водород сгорает в кислороде при давлении 29—57 атм и температуре 200—240°С. Элемент диаметром 250 мм и длиной 700 мм развивает э. д. с. в 1,02 в и позволяет получать ток до 0,7 а/см2 и мощность до 0,41 вт/см2. Эти элементы действуют до 1500 час. Генератор из 40 таких элементов вырабатывает мощность в 5 кВт при напряжении 24 в.
В Амстердамском университете (Голландия), в США и других странах построены батареи с электролитом в виде расплавленных углекислых солей щелочных металлов, работающих при 600—800°С и давлении в 2 атм. С окисью углерода (СО) в качестве горючего получался к. п. д. до 89% (при малой нагрузке)» а с водородом — до 98%. Американская фирма «Элис-Чэлмерс» объявила о построенной топливной батарее для питания трактора с электродвигателем. Топливом здесь служит горючий газ пропан (С3Н8); развиваемая мощность — около 15 кВт.
Из всех направлений работ по рациональному использованию энергии топлива это направление в принципе наиболее значительно потому, что позволяет обойтись без преобразования энергии топлива в энергию беспорядочного теплового движения и связанных с этим потерь энергии при ее дальнейших превращениях. Но трудности в его осуществлении также велики.

