В настоящее время в мире производят около 30 млн. т водорода в год. Коротко остановимся на существующих методах его получения и дадим оценку их эффективности.
Нужно учитывать, что при производстве водорода используются различные источники энергии (уголь, жидкие и газообразные топлива, ядерные установки, гидроэнергия и т. д.). Выбор того или иного источника определяет применяемый технологический процесс и его технико-экономические показатели.
Основная часть крупномасштабного промышленного производства водорода основана на конверсии углеводородов и прежде всего из природного газа. Как исходное сырье последний состоит на 95—99 % из метана. Осуществляется результирующая реакция конверсии метана водяным паром:![]()
Процесс проводят, как правило, с подводом тепла через стенку реактора. При осуществлении режима паровой каталитической конверсии углеводородов можно соответствующим выбором давления, температуры и компонентов пар — метан получать технический водород с содержанием 95—98 % чистого водорода. После конверсии газ очищают от двуокиси углерода и сернистых компонентов.
В современных установках реальный КПД составляет 60—65 % из-за потери значительной части тепла в холодильниках, через стенки конструкции, а также с выбрасываемыми в атмосферу водяными парами и двуокисью углерода.
Расчетные затраты на производство очищенного водорода методом паровой конверсии, с учетом стоимости метана, для европейской части СССР составляют (в пересчете на условное топливо) от 75 до 81 рубля за тонну.
К основным технологическим процессам получения водорода относится и парокислородная конверсия:
![]()
Достоинством этого процесса является то, что через стенки реактора не нужно подводить теплоту. Это позволяет вести процесс при повышенном давлении (до 4 МПа), несмотря на более высокие температуры. Необходимость в кислороде, получение которого связано с большими затратами электроэнергии, приводит к удорожанию процесса, КПД которого составляет 65—70 %. Расчетные затраты — около 73 рублей за тонну.
Методы паровой и парокислородной конверсии применяются и для получения водорода из водородосодержащих газов, получаемых на нефтеперерабатывающих заводах (НПЗ). Выделение его обеспечивается методами глубокого охлаждения, абсорбции, адсорбции, диффузии через мембраны. Стоимость одной тонны водорода в этом случае составляет около 100 руб.
Известно, что газификация углей возникла около 200 лет назад с целью получения светильного и водяного газов. В последующем она использовалась для получения синтез- газа (смеси СО и H2 ), заменителей природного газа, допускающих его транспортировку по трубопроводам. Были разработаны и методы получения водорода в процессе газификации углей. Однако появление более дешевых и эффективных способов получения его из природного газа приостановило работы по газификации углей. Только повышение интереса к водороду в последние годы, открытие мощных залежей угля поставили на повестку дня совершенствование старых и создание новых методов получения водорода.
В традиционных методах газификации углей, разработанных в 20—30-е годы нашего столетия (методы Лурги и Винклера), а также в созданном в 50-е годы методе Копперс-Тотцека процесс осуществляется одновременным воздействием на углерод водяного пара и кислорода. Единственным источником получения водорода служит водяной пар, а уголь — только восстановителем. При этом в основном происходят следующие реакции;
C + О2 = CO2;
С + 2H2 О = СО2+2H2 ;
С+H2 О = СО + H2 ;
С + СО2 = 2СО.
Указанные выше методы апробированы практикой и имеют как достоинства, так и недостатки. Для повышения производительности процесса делаются попытки усовершенствовать методы путем повышения давления в газификаторе.
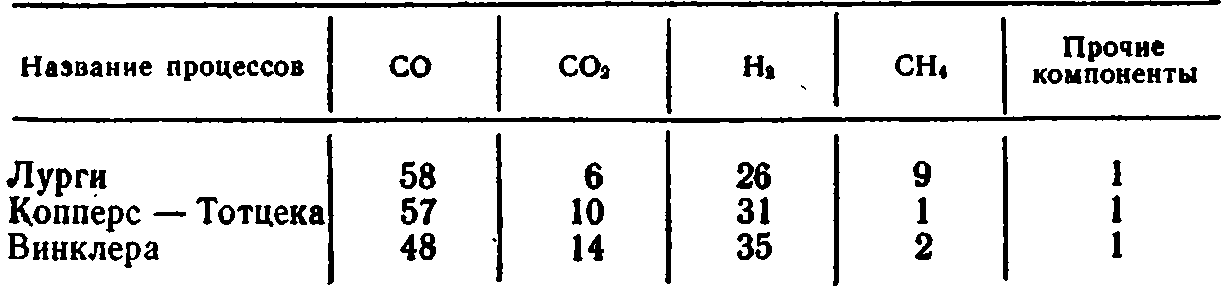
Состав получаемого газа (% по объему) показан в табл. 2.
Практическая значимость газификации углей привела к появлению принципиально новых методов, основанных на использовании многоступенчатых процессов. Одним из них является метод Хай-газ. Газификация осуществляется при высоком давлении (до 10 МПа) железнопаровым способом из кокса. Процесс начинается с газификации кокса с помощью паровоздушного дутья. Полученный газ, содержащий СО, H2 и N2, используется для восстановления окисла железа Fе3О< до FeO при температуре 1100—1200 К:
![]()
Последующая обработка окиси железа FeO водяным паром при 900—1000 К позволяет получать после конденсации воды практически чистый водород:
![]()
Таблица 2 Состав газа, получаемого традиционными методами, (% по объему)
Экономичность растет вследствие того, что реакция окиси железа с водой экзотермична и выделяющееся тепло поднимает температуру водяного газа до уровня восстановления железа.
Равновесие реакции таково, что ее продукты содержат около 37 % водорода.
Существуют и другие методы, в которых недостающую теплоту для проведения эндотермической реакции угля с водяным паром можно получить за счет побочной химической реакции. Тогда газификацию угля можно осуществить только водяным паром.
Перспективными для промышленного использования способами получения водорода являются прямой электролиз воды и разложение воды термохимически.
Электрохимический способ заключается в электролитическом разложении воды на составные части — водород и кислород. Поскольку удельный расход электроэнергии при получении водорода значителен (до 5—6 кВт-ч на 1 нм3 водорода), электролиз воды в промышленных масштабах осуществляется прежде всего в районах с низкими тарифами на электроэнергию. Так, в Норвегии, где хорошо развита сеть ГЭС, этим способом производят практически 100 % водорода.
В настоящее время разрабатывается большое число электролизеров различных типов и конструкций. По виду электролита различают три их основных типа: с водным щелочным электролитом с рабочей температурой до 500 К; твердым полимерным электролитом (ТПЭ) с температурой до 423 К; высокотемпературные (рабочая температура 1100—1300 К). Каждый из них имеет свои преимущества и недостатки. Но есть и один общий недостаток — стоимость водорода, полученного электрохимическим способом, больше в 1,5—2 раза, чем при использовании для этой цели природного газа.
Работа по совершенствованию электролизеров продолжается. Повысить эффективность щелочных электролизеров можно путем увеличения их рабочей температуры и давления. При создании электролизеров с твердым полимерным электролитом применяются дорогостоящие материалы, в частности используются катализаторы на платиновой основе. Положительные результаты, достигнутые при создании электролизеров с ТПЭ, не содержащих драгоценных металлов, получены только для специальных электролизеров с небольшим ресурсом работы. Для промышленных установок приемлемое решение пока не найдено.
Большие требования предъявляются к электродным материалам при высокотемпературном электролизе водяного пара. Они должны быть коррозионно стойкими, обладать высокой механической прочностью. Особенно высоки требования к аноду, который некоторые исследователи предлагают делать из золота, платины, серебра, сплавов редкоземельных металлов. Это, конечно, нежелательно, так как увеличивает стоимость установки. Промышленный электролизер данного типа еще не создан.
И, тем не менее, электрохимическое разложение воды в последние годы осуществляется успешно. Созданы установки с КПД (отношение полученной теплоты сгорания водорода к затраченной электроэнергии) до 70—80 %. Не исчерпаны возможности их дальнейшего совершенствования, и есть надежда, что со временем водород из воды станет дешевле, чем из природного газа, цены на который растут. В отдельных случаях и ныне выгодно получать водород электролизом в ночные часы, когда имеется лишняя и дешевая электроэнергия. Не стоит забывать, что этот процесс одновременно сопровождается получением кислорода, очень нужного и дефицитного газа.
Интересен технологический метод, разработанный фирмой «Дорнье» (ФРГ), при котором электролизу подвергается не вода, а водяной пар. Преимущество этого метода состоит в том, что часть затрачиваемой на разложение воды энергии подается в виде тепла, производство которого обходится дешевле, чем производство электроэнергии.
В последнее время часто говорят об атомно-водородной энергетике. Действительно, очень заманчиво осуществить электролиз воды на базе резервной электроэнергии АЭС в непиковый период. Иными словами, целесообразно создание ядерно-водородных станций (они уже существуют в ряде стран), работающих по схеме: реактор — водородный генератор. Именно такое сочетание претендует на роль лидера в водородной энергетике. Вне всякого сомнения, наиболее перспективным способом обеспечения высокопотенциальной теплотой (1200 К и выше) и электроэнергией процессов получения водорода является использование высокотемпературного ядерного реактора (ВТЯР). Имеются данные, что в ФРГ на реакторе тепловой мощностью 40 МВт достигнута температура теплоносителя на выходе 1220 К. В то же время у таких крупномасштабных потребителей водорода, как азотная промышленность, при синтезе аммиака, метанола до 40—45 % потребляемого природного газа сжигается для получения теплоты высокого температурного потенциала. Применение ВТЯР позволит сберечь углеводородное топливо, снизить себестоимость продукции. По мнению специалистов, использование высокопотенциального тепла ВТЯР в процессах газификации угля приведет к снижению его расхода в 1,4—1,6 раза на единицу конечного продукта.
В отличие от электролизера, при термохимических способах получения водорода тепло источника энергии используется непосредственно для расщепления воды на ее газообразные компоненты. Известно, что для осуществления процесса пар необходимо нагреть до температуры около 5000 К. Поскольку техника работы при таких высоких температурах еще не разработана, а пригодные материалы не найдены, исследуются процессы, протекающие при более низких температурах. Это так называемые термохимические циклы.
Выбор и реализация цикла должны удовлетворять ряду требований, таким, как доступность и относительная дешевизна реагентов, эффективность процесса, возможность разделения продуктов реакции. Однако главным критерием является стоимость водорода при массовом производстве.
В настоящее время предложено свыше 30 сложных термохимических циклов. Из них наиболее известны циклы «Марк», предложенные Европейским сообществом по атомной энергии («Евратом»), которые протекают по трем или четырем ступеням. В качестве примера приведем железохлорный цикл:
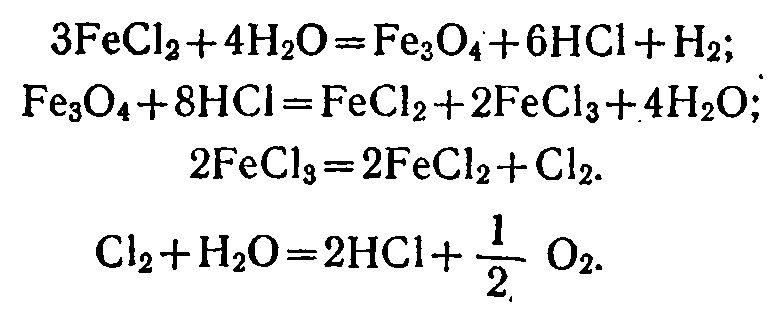
Рассмотренный здесь цикл является замкнутым, как и многие другие. Это означает, что при их осуществлении расходовались только вода и энергия, а промежуточные реагенты предполагались полностью регенерируемыми.
Однако известный интерес представляют и разомкнутые циклы, в которых исключается одна или более реакций из цепочки реакций замкнутого цикла. Это объясняется тем, что полученные таким образом циклы — это по существу хорошо известные и применяемые в современной технологии стандартные химические процессы, пригодные для дополнительного получения водорода.
Изложенные выше методы разложения воды имеют свои достоинства и несовершенства. Электролиз хорошо освоен, но относительно дорог. Термохимический метод более экономичен, но мало освоен и при нынешнем развитии техники далек еще от практической реализации. Естественно, появилась мысль создать метод, сочетающий оба подхода и использующий их преимущества. Примером такого комбинированного цикла является сернокислый цикл фирмы «Вестингауз» (США). Он состоит из двух ступеней: первая — высокотемпературная (термохимическая), вторая — низкотемпературная (электролитическая):
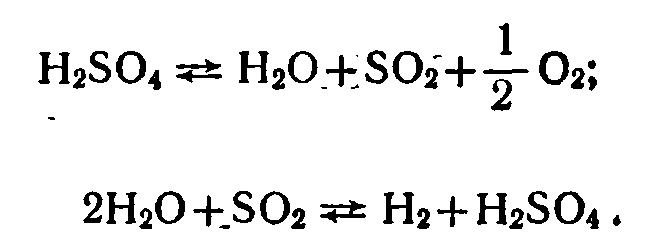
Такой подход является энергетически выгодным. Так, теоретическая электродинамическая сила (ЭДС) гальванической ячейки на последнем этапе процесса равна 0,17 В, а для прямого электролиза воды теоретически необходимо напряжение 1,23 В.
Заслуживают внимания быть отмеченными следующие способы получения водорода на передвижных установках и стационарных устройствах малой производительности:
кислотный, щелочно-алюминиевый, активированно-алюминиевый, разложения гидридов.
Кислотный способ основан на свойстве некоторых неорганических кислот взаимодействовать с металлами, выделяя водород:
Fe + H2 SO4 = FeSO4 + H2 .
Теоретически на 1 нм3 водорода требуется 2,5 кг железа и 4,4 кг серной кислоты. На практике расходы намного больше. Водород содержит до 5 % примесей.
Щелочно-алюминиевый способ базируется на свойстве алюминия давать с растворами гидроокисей щелочных металлов алюминаты, выделяя водород:
2Al+2NaOH+2H2 O=2AlNaО2+3H2 .
На производство 1 нм3 водорода затрачивается 1 кг алюминия и до 2 кг технической гидроокиси натрия. Реакция протекает бурно с выделением большого количества тепла. Чистота водорода — 98 %.
Активированный алюминий взаимодействует с водой по уравнению![]()
Активация может осуществляться обработкой порошкообразного алюминия хлористой ртутью, покрытием специальной амальгамой, добавлением в сплав индия, галия и др. Расход активированного алюминия составляет 0,9 кг на 1 нм3 водорода. Водород получается высокой чистоты (99 %).
Преимуществом производства водорода с использованием гидридов является высокий выход водорода из 1 кг сухого материала (из 1 кг LiH получается 2,81 нм3 водорода):
LiH + H2 O = LiOH+H2 .
Практическое значение для получения водорода имеют гидриды, работа с которыми безопасна и которые легко реагируют с водой в обычных условиях.
В табл. 3 приведены оценки расчетных затрат на получение товарного водорода в крупных масштабах разными методами с использованием различных источников энергии.

