Глава 2
ОБЩИЕ СВЕДЕНИЯ О ВЗАИМОДЕЙСТВИИ НАТРИЯ С ВОДОЙ
Кинетика и термодинамика химического взаимодействия натрия с водой
Химическое взаимодействие натрия и воды протекает в два этапа. На первом этапе реакция протекает с большой скоростью с выделением газообразного водорода и тепла:
![]()
(2.1)
Обратить эту реакцию практически невозможно, так как равновесное давление водорода очень велико. На втором этапе происходит химическое взаимодействие продуктов первого этапа реакции с избыточным натрием (избыток натрия характерен при течах воды в условиях парогенератора с натриевым теплоносителем):
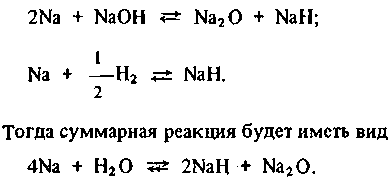
(2.2)
(2.3)
(2.4)
Таким образом, взаимодействие натрия с водой — довольно сложный, многоэтапный процесс, в котором протекают последовательные реакции образования гидроксида натрия и водорода и их последующее взаимодействие с натрием. Конечная концентрация продуктов взаимодействия воды с натрием определяется условиями термодинамического равновесия, а время достижения равновесного состояния — кинетикой протекающих реакций.
Реакция натрия с водой в конденсированном состоянии протекает с очень высокой скоростью (практически мгновенно). Однако весьма важно, что образующийся газообразный водород разъединяет реагирующие компоненты, в результате чего реальная скорость взаимодействия натрия с водой определяется перемешиванием реагентов и не носит взрывного характера. Бытующее мнение о взрывном характере взаимодействия воды с натрием связано с возможностью взрывного взаимодействия смеси водорода с газообразным кислородом, образование которой происходит при выделении образующегося водорода в среду, содержащую газообразный кислород. Инициатором взрыва такой смеси могут служить высокие температуры, которые развиваются в зоне реакции.
Многочисленными исследованиями показано, что изоляция системы натрий—вода от кислорода созданием над уровнем воды или натрия газовой полости с бескислородной атмосферой (аргон, гелий, азот) полностью исключает взрывные эффекты. Одновременно такая газовая полость служит эффективным демпфером для расширения образующегося водорода. Это исключает быстрое и значительное нагружение конструкции.
Состояние продуктов взаимодействия натрия с водой при термодинамическом равновесии. Данные по состоянию продуктов реакции натрия с водой получены как использованием расчетных методов, так и анализом проб, отобранных при проведении опытов по взаимодействию воды с натрием.
Методика термодинамических расчетов основана на решении системы уравнений, получающихся с использованием закона действующих масс для независимых реакций, протекающих в данной системе, и балансных уравнений по компонентам, участвующим в реакциях.
Основная сложность связана с выбором исходных термодинамических данных, в особенности данных по переходу от термодинамической активности к концентрациям.
При проведении расчетов считается, что реакция (2.1) идет до конца, количество натрия в системе превышает количество воды, попавшей в нее, т.е. n0Na>>nH2O, и все продукты взаимодействия находятся в натрии в растворенном состоянии, количеством водорода, находящимся в газовой фазе, можно пренебречь.
Тогда равновесные концентрации продуктов реакции находятся из системы уравнений:

первое из которых — следствие закона действующих масс, а три последних - балансные уравнения для кислорода, водорода и натрия, причем
К2.2=ехр(-ΔΖ°(2. 2)/RT).
Решение системы уравнений (2.5)-(2.8) дает:
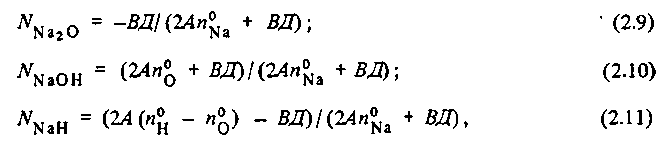
где

Расчет по (2.9) - (2.11) показывает, что с ростом температуры с 300 до 500 с![]() уменьшается с 0,17 до 0,007, а с ростом
уменьшается с 0,17 до 0,007, а с ростом
![]() доля водорода в виде гидроксида также растет. Последнее должно приводить к тому, что равновесное давление водорода над натрием, содержащим кислород и водород, будет понижаться с ростом
доля водорода в виде гидроксида также растет. Последнее должно приводить к тому, что равновесное давление водорода над натрием, содержащим кислород и водород, будет понижаться с ростом![]() Это
Это
подтверждено специальными опытами [15].
При попадании значительного количества воды в натрий указанное выше условие![]() не выполняется. При этом концентрация
не выполняется. При этом концентрация
образующихся соединений может превысить их растворимость в натрии. В этих условиях образуется каустическая фаза, состоящая из гидроксида и растворенных в нем оксида, гидрида натрия и натрия. Термодинамический анализ состава каустической фазы при допущении, что растворимость натрия в гидроксиде мала по сравнению с растворимостью гидрида и оксида [77, 76], т.е. в каустической фазе
NNa=0, показал, что основными продуктами реакции в присутствии жидкого натрия как самостоятельной фазы будут гидроксид, гидрид и оксид натрия, молярные доли которых при 450 °C и![]() ≈ 0,5 равны 0,46; 0,51;
≈ 0,5 равны 0,46; 0,51;
0,03 соответственно. С ростом температуры и n![]() доля гидроксида растет. При этом важно, что температура плавления каустической фазы, формирующейся в таких условиях, будет превышать температуру плавления чистого гидроксида.
доля гидроксида растет. При этом важно, что температура плавления каустической фазы, формирующейся в таких условиях, будет превышать температуру плавления чистого гидроксида.
В реальных условиях формирования каустической фазы температура ее плавления не превышала 400 °C. В открытой системе, когда возможна потеря водорода, температура плавления каустической фазы по мере обеднения ее водородом будет расти.
Общие закономерности, описывающие равновесное давление водорода в газовой фазе над системой натрий-кислород-водород, в настоящее время неизвестны.
Растворимость в натрии, млн-1, кислорода, водорода, а также продуктов взаимодействия натрия с водой описывается уравнениями:

В (2.19) растворимость продуктов взаимодействия натрия с водой условно рассчитана на кислород, содержащийся в воде. Сопоставление (2.17) и (2.19) показывает, что растворимость кислорода в присутствии водорода увеличивается.
На рис. 2.1 представлена диаграмма равновесных состояний системы натрий-вода в зависимости от температуры и молярной доли воды в составе реагентов [19].
Конечными продуктами реакции натрия с водой могут быть гидрид и оксид натрия в жидких растворах на основе натрия и его гидроксида, гидрид и твердый раствор гидроксида, а также водный раствор щелочи и газообразный водород.
36 Изменение концентрации продуктов взаимодействия натрия с водой в натрии и защитном газе с учетом кинетики реакций. Будем считать, что течь воды в натрий постоянна во времени. Из полного количества газообразного водорода, образующегося при взаимодействии натрия с водой, доля его, равная (1-а), находится в натрии, а остальной водород поступает в защитный газ.
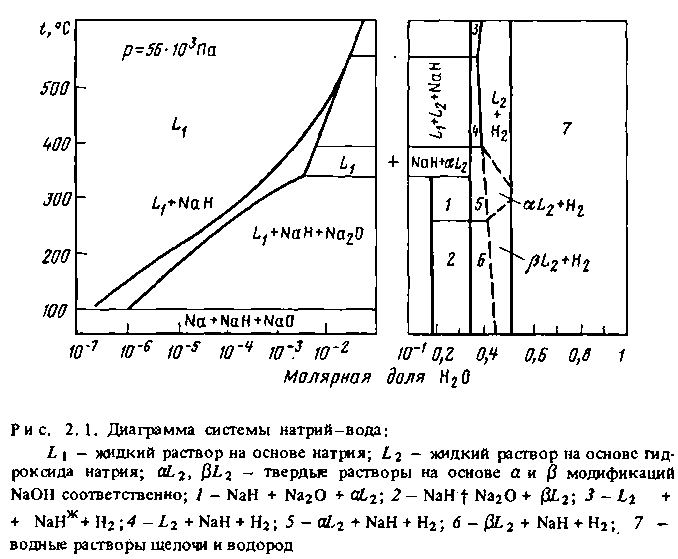
Тогда, принимая, что водород взаимодействует с натрием на поверхности раздела по реакции первого порядка, а выделение его из натрия за счет обратной реакции происходит по реакции второго порядка, а реакция гидроксида натрия с натрием гомогенна и первого порядка, и считая, что перемешивание в контуре и газовой фазе идеальное, получаем уравнения баланса:
для водорода в газе

Считая, что сферический пузырь, находящийся в движущемся вверх натрии, взаимодействует с натрием кинетически, причем скорость образования гидрида много выше скорости обратной реакции, а температура и давление водорода в пузыре равны соответствующим параметрам натрия, запишем уравнение, описывающее изменение диаметра пузыря:
![]() (2.34) где х — расстояние до места течи; Т и р- температура и давление в точке х соответственно; f (х) определяется из (2.27) [с учетом вида функции T(х) ]. Решения уравнения (2.34) для случаев wn = const и
(2.34) где х — расстояние до места течи; Т и р- температура и давление в точке х соответственно; f (х) определяется из (2.27) [с учетом вида функции T(х) ]. Решения уравнения (2.34) для случаев wn = const и
wn > wNa, когда d = d0 при х = 0, имеют вид:
в первом случае
Используя (2.35) —(2.37), можно определить расстояние, пройдя которое пузырь с начальным диаметром d0 полностью растворится, т.е. а станет равным нулю.
Из приведенных выражений видно, что доля водорода, выходящего в газовую полость, зависит от многих параметров: направления движения натрия в парогенераторе, температуры, давления, начального диаметра пузыря и др.
Водородные пузыри уносятся из парогенератора с потоком натрия. Сложность гидродинамики потока в парогенераторах и контурах не позволяет провести точную аналитическую оценку доли пузырей, выходящих в газовую полость. Однако очевидно, что чем ближе место течи к газовой полости, тем эта доля должна быть больше.
Полученные уравнения позволяют рассчитать изменение концентрации примесей в контуре во времени и оценить эффективность различных систем обнаружения течи воды в натрий.

