МЕНЬШИКОВА В. П., канд. техн. наук, ПОТАПОВА Н. В., инж., МЭИ
Высокие требования к охране окружающей среды и необходимость повышения эффективности работы водоподготовительных установок приводят к созданию новых технологических схем умягчения воды с утилизацией засоленных стоков, а также к совершенствованию схем химического обессоливания воды, направленному на использование близких к стехиометрическим расходов реагентов на регенерацию и на сокращение стоков.
При эксплуатации таких малоотходных водоподготовительных установок (ВПУ) требуется тщательный контроль качества воды по всей цепочке и, в частности, определение содержания сульфат-иона.
Контроль и нормирование этого показателя необходимы также в оборотной воде системы охлаждения с градирнями из железобетона, так как завышенные концентрации сульфат-иона могут привести к коррозии бетона.
В схемах, предусматривающих Н-катионирование, концентрацию сульфатов обычно определяют путем вычитания концентрации хлоридов из показателя кислотности воды. В настоящее время, когда в исходной воде могут быть значительные количества нитратов и нитритов, такой способ определения сульфатов становится непригодным, поскольку необходимо вводить поправку на концентрацию присутствующих в воде нитритов и нитратов. Методы определения содержания нитратов и нитритов довольно сложны, поэтому в данном случае целесообразнее определять содержание самих сульфатов.
Таким образом, нормирование и контроль концентрации сульфатов в технологических циклах обработки воды приобретает большое значение.
Концентрация сульфат-иона в различных точках ВПУ может изменяться от 1 до 50 мг-экв SO2-4 и более.
В настоящее время на электрических станциях для количественной оценки содержания сульфат-иона в таком широком диапазоне концентраций используют весовой метод, основанный на реакции взаимодействия сульфат-ионов с ионами бария, сопровождающейся образованием малорастворимого мелкокристаллического осадка сульфата бария.
Но он требует проведения очень продолжительных и
трудоемких операций, связанных с необходимостью количественного осаждения определяемого компонента и проведения большого числа разделений. Поэтому необходима замена весового метода определения содержания сульфатиона более простым и менее трудоемким. Так для количественного определения сульфат-иона в указанных концентрациях может быть использован объемный метод, основанный на титровании сульфат-ионов раствором хлористого бария.
В настоящее время для прямого титрования сульфатов ионом бария предложен ряд органических реагентов различных классов. Однако большинство индикаторов, например, ализаринсульфанат натрия, торон, фталеиовкомилексон, родизонат натрия и др., не отличаются высокой чувствительностью и четкостью перехода окраски в точке эквивалентности.
Наиболее чувствительными индикаторами к иону бария при определении содержания сульфат-иона являются карбоксиарсеназо, арсеназо III и нитхромазо. Каждый из них обладает специфическими свойствами и требует особых условий для протекания реакции с ионом бария.
В данной работе для количественного определения содержания сульфат-иона в воде был использован индикатор арсеназо III, который по предварительным исследованиям отличался большей четкостью фиксирования эквивалентной точки.
Метод основан на объемном определении концентрации сульфат-ионов за счет титрования раствором хлористого бария в ацетонововодной или спиртововодной среде при значении рН = 6 в присутствии индикатора арсеназо III.
Для выполнения определений необходимы следующие реактивы: 0,01 н раствор хлористого бария, приготовленного из фиксанала; 0,002 м водный раствор индикатора арсеназо III, для этого 0,15 г реагента растворяют в 100 мл воды; ацетон химически чистый или этиловый спирт; 0,01 н раствор серной кислоты, приготовленный также из фиксанала.
При выполнении определения 9 мл анализируемой воды отбирают пипеткой в коническую колбу вместимостью 100 мл, добавляют из микробюретки ровно 1 мл 0,01 н серной кислоты, приливают 40 мл ацетона или этилового спирта, 3 капли индикатора арсеназо III и титруют 0,01 н раствором хлористого бария до перехода розовой окраски в синефиолетовую. Расчет ведут по формуле
![]() (1)
(1)
где а — объем 0,01 н раствора ВаСЬ, пошедшего на титрование, мл; 1 — объем 0,01 н раствора H2SO4, добавленного в пробу, мл; k — коэффициент нормальности 0,01 и раствора ВаС12; 48 — грамм-эквивалент сульфат-иона; 0,01— нормальность раствора ВаСЬ; v — объем анализируемой воды, мл.
Средняя относительная ошибка при определении содержания SO2-4 в диапазоне концентраций от 0,5 до 50 мг-экв/л составляет ±5%.
Было проведено исследование оптимальных условий применения рассматриваемого метода для количественного определения содержания сульфат-иона в контурных водах энергетических установок при возможном изменении их концентрации в указанном диапазоне. Установлено, что сульфаты можно определять, используя индикатор арсеназо III, прямым титрованием раствором хлористого бария. Однако необходимо учесть, что при анализе вод с содержанием сульфатов от 0,5 до 1 мг-экв/л необходимо использовать микробюретку для дозирования раствора ВаС12 с целью увеличения точности анализа; при содержании сульфатов 15— 20 мг-экв/л целесообразно использовать 0,1 н растворы серной кислоты и хлористого бария; начиная с концентрации 20 мг-экв/л целесообразно разбавлять анализируемый раствор в 10 раз во избежание появления опалесценции, затрудняющей определение точки эквивалентности при титровании.
Поскольку в контурных водах электростанций могут присутствовать фосфаты, соли жесткости, силикаты, были проведены исследования влияния этих примесей на определение сульфатов с использованием индикатора арсеназо III. Выяснено, что соли жесткости существенно влияют на определение сульфатов этим методом. Поэтому при концентрации солей жесткости примерно 1 мг-экв/л необходимо анализируемую пробу предварительно пропустить через колонку с катионитом.
Присутствие силикатов (до 200 мг/л) не оказывает влияния на определение сульфат-нона; при концентрациях силикатов, превышающих это значение, переход окраски индикатора в точке эквивалентности ухудшается, соответственно увеличивается ошибка анализа, а при концентрации 700 мг/л определять сульфаты становится невозможно.
Наличие фосфатов (до 100 мг/л) не мешает определению сульфат-иона; при концентрациях фосфатов более 100 мг/л переход окраски индикатора в точке эквивалентности ухудшается, увеличивается ошибка анализа.
Объемный метод с индикатором арсеназо III может быть использован и для определения микроколичеств сульфат-иона в контурных водах (100 мкг/л и ниже), но для этого необходимо провести предварительное концентрирование сульфат-иона на анионите. При содержании SO2-4 от 50 до 100 мкг/л достаточно пропустить через анионит один литр анализируемой воды. При меньших содержаниях сульфатиона концентрирование следует проводить из больших объемов воды, при этом можно существенно снизить границу определяемой концентрации SO2-4. На пропускание одного литра анализируемой воды через фильтр затрачивается в среднем 30 мин.
Отработка методики концентрирования проводилась на искусственных растворах, которые получали дозированием расчетных количеств раствора серной кислоты, приготовленного из фиксанала, В-17 в карбонатной форме.
Подготовка смолы к работе состоит в следующем: 100—200 г анионита АВ-17 промывают в стакане 15—20 раз 1 н раствором карбоната аммония. В колонку высотой 400 мм и диаметром 10 мм загружают 7 мл подготовленной смолы АВ-17 в набухшем состоянии, заканчивают ее обработку пропусканием 150—200 мл 6%-ного раствора углекислого аммония со скоростью 30 мл/мин и 100 мл со скоростью 1,5—2,0 мл/мин.
Для установления полноты отмывки смолы в мерную колбу собирают последние 25 мл фильтрата и контролируют присутствие сульфат-ионов титрованием согласно описанной методике. При отрицательной реакции на сульфат-ион (изменение окраски от одной избыточной капли 0,01 н раствора ВаСЬ после связывания 1 мл введенного 0,01 н раствора1 H2SO4) обработку смолы углекислым аммонием заканчивают и промывают колонку 200 мл глубоко обессоленной воды.
Определение выполняют следующим образом: в зависимости от концентрации сульфат-ионов через колонку пропускают 1—2 л анализируемой воды со скоростью 30 мл/мин. Затем колонку промывают, используя 50 мл глубоко обессоленной воды, и десорбируют поглощенные сульфат-ионы 6%-ным раствором углекислого аммония, который пропускают со скоростью 1,5—2 мл/мин.
В фарфоровую или кварцевую чашку собирают 50 мл элюата и в ней упаривают раствор на водяной бане досуха (для разрушения карбоната аммония). При этом необходимо следить за тем, чтобы в вытяжном шкафу одновременно не производились никакие работы с серной кислотой.
Колонку промывают, пропуская 200 мл глубоко обессоленной воды со скоростью 30 мл/мин, после этого она готова для повторного использования. После 10—15 определений качество анионита в колонке следует проконтролировать п при необходимости обработку смолы повторить. Непосредственно перед использованием колонку надо промыть глубоко обессоленной водой (20 мл).
Сухой остаток из чашки количественно переносят с помощью 9 мл глубоко обессоленной воды в коническую колбу вместимостью 100 мл, добавляют из микробюретки 1, мл 0,01 н серной кислоты, приливают 40 мл ацетона, 3 капли индикатора арсеназо III и титруют 0,1 н раствором хлористого бария до перехода розовой окраски в синефиолетовую. Расчет выполняют по формуле (1).
Результаты определения микрограммовых концентраций ионов SO2-4 в водных растворах после концентрирования их на анионите АВ-17 приведены в таблице.
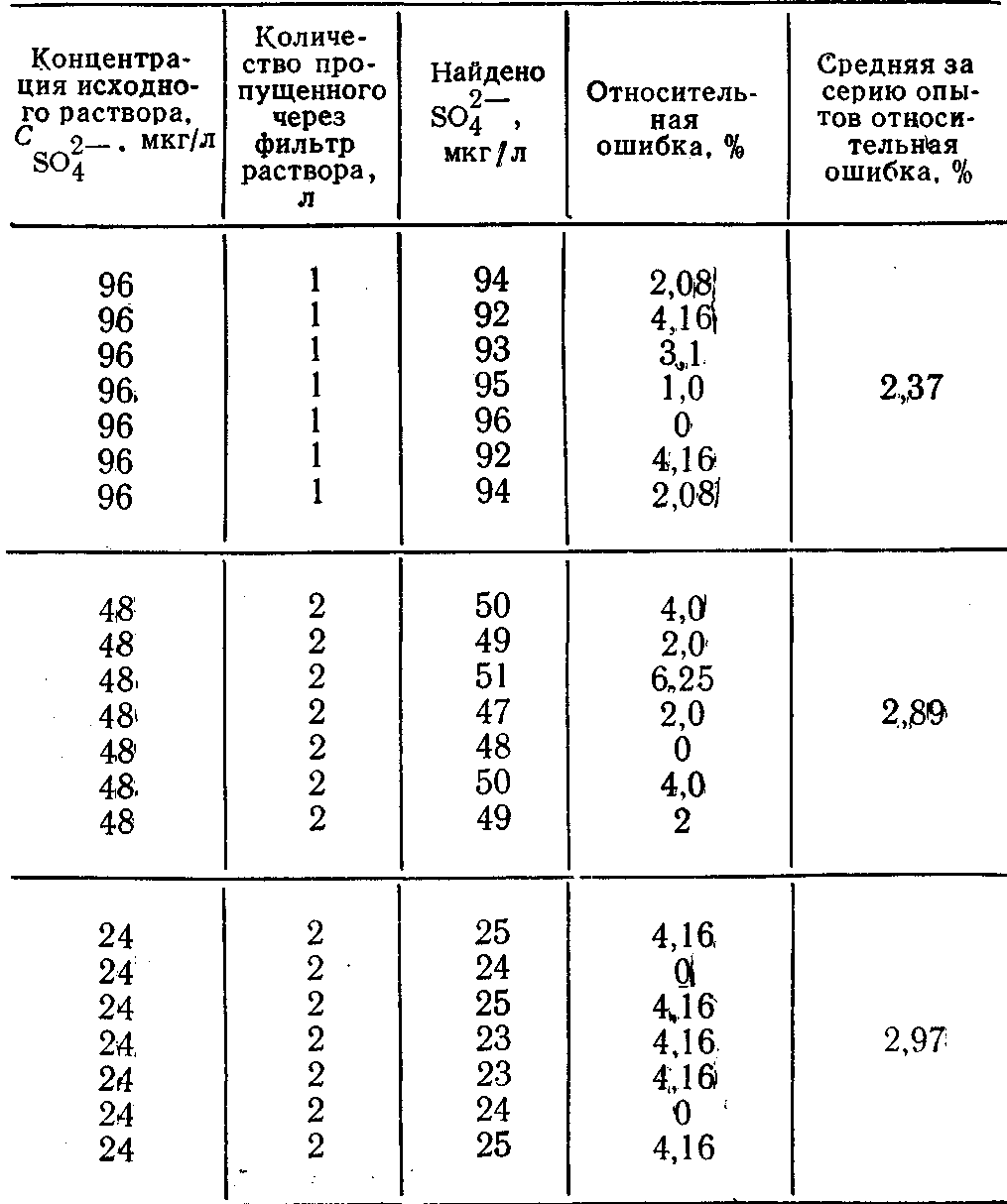
Из анализа полученных данных следует, что метод концентрирования на анионите АВ-17 в карбонатной форме дает хорошие результаты при определении микрограммовых концентраций SO2-4 в контурной воде.
Для количественного определения SO2-4 в пределах изменения концентраций от 0,5 до 8 мг/л, трудно определяемых данными методами, рекомендуется использовать фотоколориметрический метод с применением индикатора нитхромазо.
Таким образом, предложенные методы позволяют количественно определять содержание сульфат-иона в водных растворах в широком диапазоне изменения концентраций — от микрограммовых до 50 мг-экв/л и более.
Басаргин Н. Н. и др. Фотометрическое определение микроколичеств сульфат-иона или серы с применением нитхромазо. — Журнал аналитической химии т. XXIII, в. 5, с; 732—735.

