ГЛАВА 4
СТАЛИ И СПЛАВЫ ДЛЯ УСТАНОВОК С НАТРИЕВЫМ ТЕПЛОНОСИТЕЛЕМ
КОРРОЗИОННАЯ СТОЙКОСТЬ СТАЛЕЙ В ЖИДКОМ НАТРИИ
Коррозия в натрии, так же как и в других жидкометаллических теплоносителях, отличается от взаимодействия с водой и водными средами отсутствием электрохимических процессов с передачей электронов от окисляемого вещества.
В жидком натрии коррозия является результатом протекания следующих основных процессов: растворения, термического и концентрационного переноса массы, химического взаимодействия с примесями. Основой термического и концентрационного переноса массы является растворение. Оно в значительной степени определяет скорость этих процессов.
Натрий является одним из наименее агрессивных жидкометаллических теплоносителей по отношению к конструкционным материалам. Слабое взаимодействие объясняется низкой растворимостью и скоростью растворения в нем железа, хрома, никеля и других элементов, составляющих основу теплоустойчивых и жаропрочных материалов. В интервале температуры 400—700 °С растворимость железа составляет лишь (1—2)-10_3%, а никеля 10-2—10-3%. В соответствии с этим, как показали многочисленные эксперименты в лабораторных условиях, скорость коррозии железа и хромоникелевых аустенитных сталей весьма мала и обычно не превышает 1—10 мкм/год при температуре работы основных узлов энергетических установок 600—650 °С 1251. Эти значения относятся к испытаниям в натрии, чистом но примесям. Различие примерно в 10 раз возможных скоростей коррозии объясняется различным составом исследованных сталей, разными скоростями циркуляции натрия, особенностями испытательного оборудования и др. Подтверждение правильности результатов лабораторных испытаний получено, в частности, при исследовании трубопровода из стали 304L, проработавшего в составе энергетической установки в течение 21 000 ч [260]. Режим эксплуатации был следующим: 4695 ч при 800 °C; 2069 ч при 649 °C; 1000 ч при 300—649 оС; 13 000 ч при 645 °C. Утонение стенки трубы от коррозии составило около 0,05 мм.
Степень воздействия натрия на конструкционные материалы зависит от многих параметров. Важнейшими из них являются температура, скорость потока натрия, содержание примесей в теплоносителе, время и др.
Установлено, что температурная зависимость коррозии имеет экспоненциальный характер. Энергия активации процесса коррозии составляет 62—190 кДж/моль. Характер этой зависимости от содержания кислорода в натрии не меняется (рис. 4.1). Вместе с тем энергия активации процесса коррозии уменьшается с повышением содержания кислорода в натрии.
Скорость коррозии хромоникелевых сталей уменьшается с увеличением длительности испытаний. В начальном периоде испытаний скорость коррозии выше из-за селективного растворения никеля, хрома, марганца и других элементов, имеющих большую по сравнению с основой стали скорость растворения. По истечении 500—2000 ч скорость растворения становится постоянной, и именно ее принимают для экстраполяции коррозии на длительное время.
Повышение скорости потока натрия обычно увеличивает скорость коррозии сталей (рис. 4.2). Происходит это вследствие утонения толщины диффузионного приграничного слоя жидкости. При значительных скоростях приграничный слой жидкости становится тонким. В этом случае растворение контролируется кинетическим режимом.

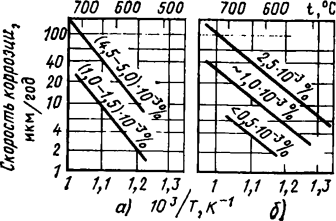
Рис. 4.1. Температурная зависимость скорости коррозии стали марки 18-10 в натрии при различном содержании кислорода по данным работ [67] (а) и [197] (б)
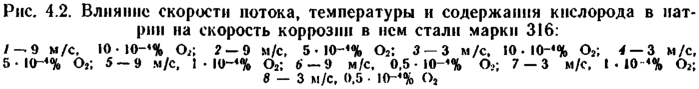
Скорость коррозии перестает зависеть от скорости натрия. Считается, что скорость коррозии конструкционных материалов зависит от скорости потока в степени п.
При ламинарном потоке п ≈ 0,5, при турбулентном п да 0,8.
Для хромоникелевых сталей влияние скорости потока натрия исчезает при скоростях, больших 3—7 м/с [81]. Для чистого никеля и никелевых сплавов влияние скорости потока наблюдается вплоть до 12 м/с (табл. 4.1).
Таблица 4.1. Влияние скорости натрия на коррозию сплава Х20Н70Т2Ю при 650 °С

В натрии, как и в любом другом жидкометаллическом теплоносителе, возможно возникновение кавитации. В кавитирующем потоке конструкционные материалы подвергаются интенсивному микроудар- ному воздействию, приводящему к эрозии. Кавитация возникает при определенной скорости потока, зависящей в первую очередь от конфигурации участка, давления в системе и плотности жидкости:
![]() (4-1) где Рвх — давление на входе в рассматриваемый участок; σкр — критический коэффициент кавитации, зависящий от конфигурации участка; р — плотность.
(4-1) где Рвх — давление на входе в рассматриваемый участок; σкр — критический коэффициент кавитации, зависящий от конфигурации участка; р — плотность.
В работе определены критические коэффициенты кавитации для трубопроводов с разными видами изменения сечений. Опыты проводились в ртути. Показано, что коэффициенты кавитации могут изменяться в широких пределах. Для плавного изменения сечения (трубка Вентури) коэффициент имеет значение около 1. Максимальное значение для исследованных моделей коэффициент кавитации имел в случае продольного обтекания труб с дистанционирующими решетками (σ= 4).
Расчет по формуле (4.1) показывает, что критическая скорость, при которой возможно возникновение кавитации в натрии в трубопроводах с σ= 1-4, составляет от 30 до 16 м/с. Давление при расчете взято равным 0,5 МПа. Для больших давлений критические скорости кавитации будут еще выше. В литературе приводятся сведения об экспериментальном подтверждении приведенных расчетов. С учетом теоретических оценок и экспериментальных данных, полученных при скоростях потока от 2 до 25 м/с, можно утверждать, что возникновение эрозионных повреждений сталей в теплоносителе при параметрах, соответствующих современным быстрым реакторам, маловероятно.
Натрий обладает большим сродством к кислороду, поэтому последний является постоянной примесью теплоносителя. Растворимость его в интервале температуры 200—600 °С составляет от 10-3 до 0,3%.
Кислород в количестве, даже существенно меньшем предельной растворимости, определяет степень коррозионного воздействия натрия. Скорость коррозии может увеличиваться пропорционально концентрации кислорода в натрии в степени от 1 до 1,6. В частности, при повышении концентрации кислорода от 5-10-4 до 5-10-3% скорость коррозии возрастает на порядок. Этот эффект проявляется практически для всех материалов в неизотермических условиях. В литературе приводятся эмпирические уравнения, учитывающие влияние концентрации кислорода при различной температуре.
Подсчеты по уравнению (4.2) дают результаты, близкие к экспериментальным при содержании кислорода в натрии 1-10-3—8·10-2 % в интервале температуры 500—700 °С. Примеры влияния кислорода при меньших концентрациях (10-3—10-4 %) на скорость коррозии даны на рис. 4.1 и 4.2.
Следует отметить, что железо и перлитные стали более чувствительны к содержанию кислорода в натрии, чем аустенитные хромоникелевые стали. Для чистого железа зависимость скорости коррозии от концентрации кислорода определяется концентрацией его в степени 2. В качестве примера на рис. 4.3 приведены результаты испытаний стали 2,25Сr—1Мо в натрии с разной концентрацией кислорода. Из этого же рисунка видно, что термическая обработка оказывает некоторое влияние на скорость коррозии. Ускоряющее влияние кислорода на коррозию сталей в натрии объясняется образованием окислов железа. В горячей части системы проходит реакция
![]() (4.3) в холодной части неизотермической системы FeO восстанавливается натрием до металла:
(4.3) в холодной части неизотермической системы FeO восстанавливается натрием до металла:
![]() (4.4)
(4.4)
Наряду с окислами железа возможно образование более сложных соединений — ферратов FeO-Na2O, FeO (Na2O)2. Окисные соединения этого типа имеют плохое сцепление с твердой подложкой — легко смываются натрием и переносятся в холодную часть системы.
Авторы работы [98] предлагают для оценки скорости коррозии стали 316 следующую зависимость:
(4.2)
![]()
где К —скорость коррозии, мг/(см2-ч); С —концентрация кислорода в натрии, %; Q — энергия активации, Дж/моль (109·103 Дж/моль); R — универсальная газовая постоянная [8,31 Дж/(кмоль-град)]; Т — температура, К.
Приводятся разные сведения о содержании кислорода, при котором образуются ферраты. Обычно указывается, что соединения типа ферратов образовывались при активности кислорода, равной 0,2—0,5. В работе [80] ферраты были обнаружены при концентрации кислорода (10—15)· 10-4% при температуре 350 °С, что соответствует активности ~0,05. Показав экспериментально ионную природу кислорода в натрии, авторы работы [98] другим образом трактуют механизм коррозии. В практически важном диапазоне концентрации кислорода в натрии коррозия начинается с растворения железа и перехода его в приграничный диффузионный слой. При наличии ионов кислорода на границе слоя происходит реакция
![]() (4.5)
(4.5)
Образование молекул FeO нарушает равновесие в диффузионном слое, что приводит к ускоренному переходу в него железа. Одновременно происходит вторичная реакция с компенсацией электронов:
![]() (4.6)
(4.6)
Молекулы FeO диффундируют в толщу жидкого металла, где концентрация железа мала. Поэтому в массе жидкого натрия возможно протекание обратной реакции:
![]() (4.7)
(4.7)
В конечном счете процесс протекает без затраты кислорода. Последний играет роль катализатора коррозии. Для предотвращения коррозии в инженерной практике предельно допустимым содержанием кислорода считается концентрация 10-8 %. В отдельных случаях требуется обеспечение концентрации кислорода на более низком уровне, например 5·10-4 %.
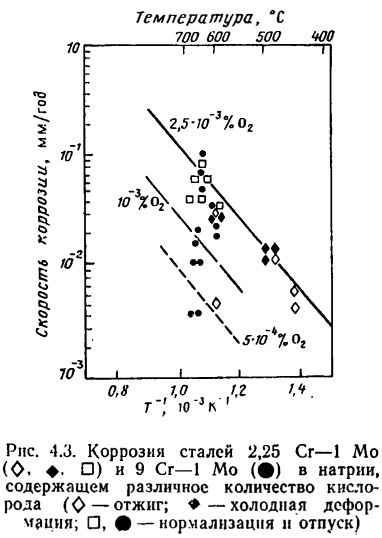

Рис. 4.4. Зависимость скорости коррозии сплавов на никелевой основе в потоке натрия от температуры (700—930 °С):
1- 1Х20Н75ТЗ; 2 - 0Х18Н60ЮЗ; 3 — IX20HMC2
Обычно коррозия в натрии, представляющая собой растворение металла и перенос растворенных масс, идет равномерно. При повышенном содержании кислорода в натрии возможна локализация ее по границам зерен. Межкристаллитный характер коррозии связан с взаимодействием неметаллических включений типов SiO2, Аl2O3 и др. с натрием. Процесс коррозии ускоряется из-за сплавления окислов на границах зерен с окислами натрия и образования легкоплавких эвтектик, например типа Na2O-2SiO2 с температурой плавления 793°С.
Авторы работы [98] наблюдали коррозию по границам зерен аустенитных хромоникелевых сталей при 600 °С и концентрации кислорода 7·10—%. За 5100 ч глубина межкристаллитного проникновения составила 70—150 мкм для сталей марок 1Х18Н10Т, X20H14C2 (ЭИ-211), Х18Н12МЗТ (ЭИ-448).
Другим процессом, характерным для коррозии в натрии, является обеднение поверхности нержавеющих сталей элементами, обладающими высокой растворимостью в нем: Ni, Сг, Мп. Значительное изменение состава поверхностных слоев металла происходит при температуре 600 °С и выше. Глубина обедненного слоя увеличивается с повышением температуры, времени испытания и концентрации кислорода в натрии. Величина измененной зоны обычно сопоставима с уменьшением размеров образца вследствие растворения. При температуре 650 °С и времени 500 ч, например, сталь 304 имела слои с пониженным содержанием Ni и Сr толщиной 5—10 мкм.
В результате избирательной коррозии поверхности нержавеющих сталей происходят структурные изменения материала. Поверхностный слой после работы в контакте с натрием может иметь ферритную структуру, что зафиксировано металлографическими и рентгеноструктурными методами.
Локальное удаление некоторых легирующих элементов может усиливаться вблизи границ зерен. Показано, что в хромоникелевой стали типа 15-15 после испытаний в потоке натрия, имевшем скорость 2,7 м/с, при температуре 730 СС в течение 1500 ч может иметь место обеднение границ зерен. Различие содержания Сr и Ni на поверхности образца в теле зерна и на границе достигает 4—8%.
По той же причине из-за более высокой растворимости и скорости растворения никеля хромоникелевые аустенитные стали с повышенным содержанием никеля и тем более сплавы на никелевой основе обладают, как правило, меньшей коррозионной стойкостью. Опыты, проведенные при температуре 600 °С, показали, что скорость коррозии линейно зависит от содержания никеля в стали или сплаве. На рис. 4.4 приведены результаты исследований жаропрочных высоконикелевых сплавов в сравнении со сталью 1Х20Н14С2 при различной температуре. Скорость коррозии сплавов, содержащих 60— 75%Ni, примерно в 10 раз выше, чем стали.
Другой важный легирующий элемент — хром, обязательно присутствующий в жаропрочных сталях, также понижает коррозионную стойкость сталей в натрии. Однако его влияние на коррозию меньше, чем никеля. При температуре около 750 °С влияние хрома на коррозию примерно в 2 раза меньше, чем никеля.
Важным процессом взаимодействия натрия с конструкционными материалами является перераспределение углерода. Перенос углерода определяется активностью его в натрии и в твердом металле. Принципиально возможно обезуглероживание и науглероживание аустенитных сталей.
В монометаллических системах направление процесса в первую очередь определяется концентрацией углерода и натрии и температурой. Рисунок 4.5 демонстрирует направленность процесса для сталей марок 304 и 316 с первоначальным содержанием углерода 0,05% в зависимости от температуры и концентрации углерода в натрии в изотермических условиях. При помещении стали в натрий с температурноконцентрационными параметрами ниже граничной линии имеет место науглероживание. Практически оно наблюдается при температуре примерно на 110° ниже температуры граничной линии. Концентрация углерода на поверхности может достигать значений, больших 0,14%. Науглероживание становится значительным при времени более 4000 ч и ограничивается поверхностным слоем. Обезуглероживание развивается при более высокой температуре, происходит на большую глубину и с большей скоростью.
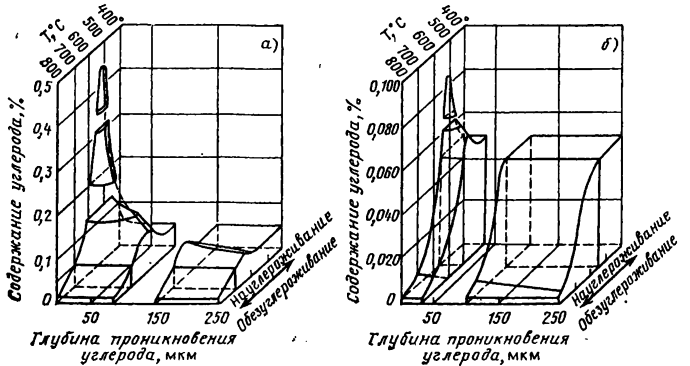
Рис. 4.6. Изменение концентрации углерода в хромоникелевой стали марки 0Х19Н9, находящейся в контакте с натрием, содержащим 0,000013% С (а) и 0,0000017% С (б). Начальное содержание углерода в стали 0,05%. Время 10 000 ч
Рис. 4.5. Диаграмма поведения сталей 0X19149 и 0Х17Ш2М2 в зависимости от температуры и концентрации углерода в натрии

На рис. 4.6 приведены диаграммы, дающие обобщенное представление о повреждении стали 304 [242] в движущемся натрии, содержащем (0,017—0,13) • 10-4% углерода. Длительность контакта с теплоносителем 10 000 ч. При содержании углерода в натрии 0,017 • 10-4% сталь обезуглероживалась до 0,003—0,005% при температуре выше 700 °С, а при содержании 0,13 • 10-4% для стали с исходным содержанием углерода 0,05% при температуре 700 °С наблюдалось почти равновесное состояние.
Легирование сильными карбидообразующими элементами может заметно уменьшить обезуглероживание аустенитных сталей. Так, стабилизированная ниобием сталь марки 0Х16Н15МЗБ при температуре ниже 800 °С обезуглероживалась мало, а стали марок 321, 347 и сплав инколой-800 после испытания при температуре 705 °С в течение 15000 ч не обезуглероживались. Не стабилизированные стали 316 и 304 заметно теряют углерод при температуре выше 650 °С. В опытах со сталью снижение содержания углерода в образцах толщиной 0,7 мм составило до 95% при температуре 705 °С за время около 15 000 ч [268]. Несколько лучшее сопротивление обезуглероживанию имела сталь марки 316.
Существующие проекты реакторов на быстрых нейтронах предполагают температуру натрия на выходе около 600 °С. При этой температуре нержавеющие стали будут науглероживаться при концентрациях углерода в натрии, возможных при эксплуатации быстрых реакторов. Для стали марки 304 проведен расчет степени науглероживания за 30 лет, что составляет предполагаемый срок службы аппаратов на быстрых нейтронах (рис. 4.7). Содержание углерода на поверхности трубы промежуточного теплообменника может увеличиться до 0,16%, т. е. стать в 3 раза большим, чем в исходном состоянии [242]. Возможность науглероживания сталей в первом контуре установки БН-350 была показана расчетным путем в работе [120].
Насыщение сталей углеродом приводит к изменению механических свойств. Наблюдается увеличение прочности и снижение пластичности. Для предотвращения или уменьшения науглероживания и соответствующего изменения механических свойств регламентируют содержание углерода в натрии. Поставляемый отечественной промышленностью натрий содержит (6—7)•10-3% углерода. Перед заполнением контуров энергетической установки натрий очищают. Например, натрий, применяемый в реакторе БН-350, содержит 2•10-8% углерода. Такое же содержание углерода принято как предельно допустимое для проекта быстрых жидкометаллических натриевых реакторов за рубежом.
Сходно с углеродом влияние на поведение сталей в натрии другого элемента внедрения — азота. Приводятся сведения, что при 705 °С не стабилизированные стали марок 304 и 316 могут терять до 75% азота за 15 000 ч. Толщина образцов составляла 0,7 мм. Стабилизированные стали марок 321 и 347 теряют азот в несколько меньшем количестве 1268]. В работе [9] приводятся сведения об азотировании трактов стенда из стали Х18Н10Т на глубину 10 мкм после 1 года работы при температуре 450 °С. Азот переносился натрием из газовой полости. Другие примеси, содержащиеся в натрии (К, Са и др.), также могут повлиять на коррозионную активность натрия, хотя и меньше, чем кислород. Имеются сведения, что при температуре 600—750 °С калий значительно интенсифицирует перенос углерода от перлитных сталей к аустенитным, а небольшие добавки кальция существенно тормозят этот процесс.
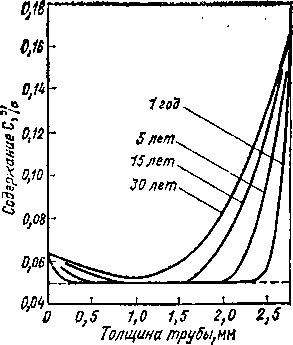

Рис. 4.7. Науглероживание стали марки 304 в натрии первого и промежуточного теплообменников в течение различного времени
Рис. 4.8. Сопротивление термической усталости стали типа 18-8 в натрии (●) и на воздухе (О); максимальная температура цикла 650 °С
Нейтронное облучение способно повлиять на коррозию сталей в натрии. Можно предполагать, что под влиянием его должно произойти увеличение скорости растворения. Экспериментально это предположение не проверялось.
Натрий не является адсорбционно-активным жидким металлом. Поэтому он не влияет на прочность и пластичность сталей при кратковременном разрыве. Показано, что закаленная и отпущенная сталь (с пределом прочности 1430 МПа), углеродистая сталь, армко-железо, сталь 316 не изменяют своих свойств при разрыве в натрии [245].
Поведение аустенитных сталей и сплавов при длительном нагружении зависит от чистоты натрия. В натрии, чистом по кислороду, при температуре 600—650 °С длительная прочность этих материалов заметно не меняется. В некоторых случаях даже наблюдалось повышение длительной прочности по сравнению с испытаниями на воздухе. Его можно объяснить меньшей коррозией в натрии, чем на воздухе. При повышенной концентрации кислорода наблюдали понижение длительной прочности. Заметно снижается в натрии длительная прочность сплавов с повышенным содержанием никеля при температуре выше 700 °С в результате интенсивной коррозии.
Натрий не оказывает отрицательного влияния на термоциклическую прочность хромоникелевых аустенитных сталей. Было показано, что образцы из стали Х18Н9 в натрии имели даже более высокое сопротивление термоусталостному нагружению, чем на воздухе (рис. 4.8) [26].
В ряде работ показано, что усталостная прочность стали в изотермических условиях не изменяется при контакте с натрием. Обычно эти эксперименты проводились в течение короткого времени при частоте нагружения, применяемой для определения выносливости при многоцикловом нагружении. Отсутствие влияния среды установлено для широкого диапазона температуры 300—725 °С.
Исследование хромоникелевых аустенитных сталей в условиях изотермического малоциклового нагружения показало, что контакт с натрием приводит к некоторому повышению усталостной прочности при 550 °С. Сталь марки 316 имела время до разрушения в натрии в 3—4 раза больше, чем на воздухе, для стали 304 существенного различия не обнаружено. Натрии, применявшийся для испытаний, содержал около 0,3 • 10-4% углерода и 1 • 10-4% кислорода и являлся науглероживающей средой по отношению к аустенитным сталям. Аналогичные результаты получены в работе 12091. Испытания стали Х18Н10 (0,03% С, 18,6% Сr, 10,9% Ni) в натрии при 550 °С показали, что при деформации в цикле 0,4—1,2% наблюдается некоторое повышение циклической прочности. При меньшей и большей деформации влияние среды на малоцикловую усталость отсутствовало.
Повышенное сопротивление циклическому нагружению сталей в контакте с натрием объясняется отсутствием адсорбционного действия среды и меньшими коррозионными повреждениями в натрии по сравнению с воздухом. В ряде случаев повышение циклической прочности в натрии является следствием науглероживания поверхностного слоя стали. Поскольку изменение механических свойств сталей в контакте с натрием вызывается изменением содержания углерода, представляется возможным рассчитать корректирующие множители для оценки возможного изменения механических свойств (табл. 4.2).
При одновременном контакте с натрием разнородных материалов коррозионные процессы могут заметно усложниться. Как правило, такими разнородными материалами являются стали аустенитного и перлитного классов в третьем контуре энергетической установки. Наряду с обычной коррозией в теплоносителе в этом случае имеет место перераспределение углерода. Перераспределение углерода может происходить вследствие его разной концентрации в материалах или отличия в содержании карбидообразующих элементов. Движущей силой этого процесса является различие в активности углерода.
Таблица 4.2. Корректирующие множители возможного изменения свойств при выдержке в натрии

Примечание. П — свойства низкоуглеродистой модификации стали.
Активность углерода в стали является функцией концентрации углерода, концентрации карбидообразующих элементов и свободной энергии образования карбидов. Перенос углерода в натрии происходит от стали с большей активностью к стали, имеющей меньшую активность, и продолжается до выравнивания активностей углерода. Процесс перераспределения углерода состоит из следующих стадий: диссоциации карбидной фазы, следующей за обеднением прилежащего раствора углерода в железе; диффузии углерода к поверхности раздела твердый — жидкий металл; окисления углерода или его растворения; диффузии или переноса углерода натрием; диффузии углерода в аустенитной стали; образования карбидов. Скорость переноса определяется стадией с минимальной скоростью. Экспериментально установлено, что стадиями, имеющими наименьшую скорость, являются диффузия углерода и диссоциация карбидов в перлитной стали. Скорость же диффузии в жидком натрии на 1—3 порядка выше, чем в твердых металлах. В аустенитной стали по сравнению с перлитной короче пути диффузии и выше скорость образования карбидов.
Поэтому химический состав перлитной стали определяет скорость перераспределения углерода и обезуглероживания. В силу этого обстоятельства скорость потока жидкого металла нс должна сказываться на скорости переноса углерода. Это подтверждено экспериментально. По той же причине практически отсутствует зависимость глубины и степени обезуглероживания от соотношения поверхностей перлитной и аустенитной сталей.
На скорость перераспределения углерода в гетерогенной системе заметно влияет содержание углерода в жидком натрии.

Растворимость углерода в натрии может достигать значений, близких к растворимости углерода в сталях. Равновесная концентрация углерода в натрии определяется следующими уравнениями: при содержании кислорода в натрии тысячные доли процента: 1n M = 4,96 — (621 /Т); (4.8)
при содержании кислорода в натрии сотые доли процента
1n M= 5,61 — (376/Т) (4.9)
где М — содержание углерода в натрии, %; Т — температура, К.
В натрии возможно также образование соединений с углеродом типов Na6(СО)6, Na2C и др. При повышенном содержании углерода в натрии процесс его удаления из перлитной стали может затормозиться или вовсе прекратиться.
Влияние содержания кислорода в натрии на скорость переноса углерода изучено весьма обстоятельно. Кислород практически не влияет на степень обезуглероживания перлитной и науглероживания аустенитной стали. Было показано, например, что при изменении содержания кислорода от 2·10-4 до 6·10-2% не происходит изменения глубины и степени обезуглероживания стали типа 08Х3М.
Перераспределение углерода исследовано Ю. М. Трапезниковым в системе перлитная сталь 1Х2М — аустенитная сталь Х18Н9Т с помощью радиоактивного изотопа углерода 14С, добавленного в перлитную сталь при ее выплавке. Опыты велись в изотермических условиях в ампулах. Показано, что снижение содержания кислорода до 10-8% или увеличение его до предельной растворимости при температуре 600 и 650 °С не приводит к изменению скорости обезуглероживания перлитной стали. Степень и глубину обезуглероживания определяли послойным замером интенсивности излучения поверхности образцов, выдержанных в натрии, по сравнению с исходным состоянием.
Введение в натрий еще большего количества кислорода путем добавок 6 и 10% NaOH также не привело к изменению скорости обезуглероживания стали 1Х2М по сравнению с испытанием в чистом по кислороду натрии. Исключением может являться процесс переноса углерода путем образования окиси углерода, наблюдавшийся для высокоуглеродистых сталей.
Обезуглероживание перлитной стали зависит от температуры и времени испытания, характера и степени ее легирования.
С повышением температуры обезуглероживание перлитных сталей увеличивается. На рис. 4.9 в качестве примера приведены результаты испытаний стали 1Х2М в натрии при различной температуре. Опыты проводились в ампулах, в качестве индикатора процесса использовался радиоактивный углерод 14С. Результаты послойного анализа после испытаний длительностью 4000 ч свидетельствуют о существенном увеличении глубины обезуглероженного слоя при изменении температуры ампул от 450 до 600 °С. Показано, что обезуглероживание сталей при различном времени испытаний пропорционально √t, т. е. кинетика процесса такая же, как при диффузии углерода в твердых металлах:
![]() (4.10) где M-степень обезуглероживания; K -постоянная для данной температуры и марки стали; t- время.
(4.10) где M-степень обезуглероживания; K -постоянная для данной температуры и марки стали; t- время.
На рис. 4.10 приведены результаты работы [224], подтверждающие указанную закономерность на стали2,25Сr—1Мо. Детальное изучение обезуглероживания на сталях, выплавляемых разными способами (электрошлаковым переплавом, вакуумно-дуговым переплавом), показало, что указанная закономерность может нарушаться из-за отличия в структуре карбидной фазы. По этой же причине степень обезуглероживания перлитных сталей может зависеть от вида применяемой термической обработки. Опыты, проведенные в статических условиях и в петлях с принудительной циркуляцией на образцах из стали 2,25 Сr—1Мо, показали, что по степени увеличения сопротивления обезуглероживанию виды термообработки можно расположить в следующий ряд: нормализация, отжиг, нормализация с отпуском (см. рис. 4.3). Увеличение продолжительности отпуска благоприятно сказывается на сопротивлении обезуглероживанию.
Легирование перлитных сталей карбидообразующими элементами приводит к уменьшению, а при достаточном их количестве к полному предотвращению обезуглероживания в натрии вследствие концентрационного переноса массы. Происходит это по двум причинам. Легирующие элементы могут снижать коэффициент диффузии углерода в железе и уменьшать скорость диссоциации карбидов.
По степени влияния на предотвращение обезуглероживания карбидообразующие элементы можно расположить в следующий ряд: Ti, Nb, V, Cr, Mo, Mn. Титан наиболее сильно тормозит обезуглероживание, марганец— меньше всего, никель и кремний усиливают обезуглероживание перлитной стали. Для предотвращения обезуглероживания практически необходимо легировать сталь титаном и ниобием в количестве, превышающем суммарное атомное содержание углерода к азота, т. е. связать весь углерод и азот стали в прочные карбиды и карбонитриды.
Эту задачу можно выполнить, конечно, и введением других карбидообразующих элементов. В известной степени можно считать эквивалентным легирование углеродистой стали 1% ниобия, или 0,5% титана, или 5% хрома, или 4% хрома и 0,3% ванадия. При большем легировании перлитных сталей сильными карбидообразователями происходит обратный процесс—науглероживание перлитных сталей.
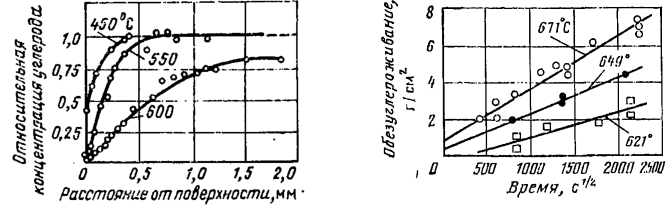
Рис. 4.9. Относительное изменение концентрации углерода в стали 1Х2М после 4000 ч выдержки в натрии при различной температуре
Рис. 4.10. Обезуглероживание стали 2,25 Cr—1 Мо при различной температуре
Не всегда рационально легировать перлитные стали до полного предотвращения обезуглероживания из-за ухудшения их технологических свойств: горячей деформируемости, свариваемости и др. Практически некоторое обезуглероживание сталей, применяемых в энергоустановках, допускается. Опыты на сталях с разным содержанием углерода и обезуглероженных материалах показали, что понижение концентрации его па 30% исходного значения приводит к снижению пределов текучести и длительной прочности на 12—05 %.
В реальных теплопередающих системах с натриевым теплоносителем конструкционные материалы выбираются таким образом, что перераспределение углерода приводит к обезуглероживанию перлитных сталей и науглероживанию аустенитных сталей. Поскольку конструкции теплообменников включают элементы малой толщины (трубные системы толщиной 1,5—2 мм), важно оценить степень науглероживания и изменение механических свойств в первую очередь аустенитных сталей.
Скорость и степень насыщения углеродом зависят от количества подводимого углерода и диффузионной подвижности его в стали или сплаве. В свою очередь количество подводимого углерода определяется соотношением поверхностей перлитной и аустенитной сталей.
Чем больше это отношение Fn/Fа =n, тем выше концентрация углерода в поверхностном слое.
Существенное влияние на науглероживание оказывают температура и время работы в натрии. В опытах, проведенных с использованием радиоактивных изотопов, было показано, что степень науглероживания экспоненциально зависит от температуры. Энергия активации науглероживания составляет 96—121 кДж/моль, что близко к энергии активации процесса диффузии углерода в γ-железе (134 кДж/моль). В литературе приводятся сведения о нарушении в ряде случаев этой закономерности. В работе [1191 сообщается, что для стали марки 304 науглероживание в интервале температуры 350— 600 °С практически не зависит от температуры.
Влияние времени науглероживания т определяется зависимостью
![]() (4.11) где т — количество поглощенного углерода; ∆С — среднее приращение содержания углерода; l— глубина науглероживания; р — кинетический параметр науглероживания, зависящий от температуры, количества подводимого углерода и его диффузионной подвижности в стали. В результате науглероживания аустенитных сталей происходит повышение концентрации углерода до предельной растворимости и образование карбидов, в основном (CrFe)23C6.
(4.11) где т — количество поглощенного углерода; ∆С — среднее приращение содержания углерода; l— глубина науглероживания; р — кинетический параметр науглероживания, зависящий от температуры, количества подводимого углерода и его диффузионной подвижности в стали. В результате науглероживания аустенитных сталей происходит повышение концентрации углерода до предельной растворимости и образование карбидов, в основном (CrFe)23C6.
Влияние науглероживания на механические свойства аустенитных сталей изучали на сталях, выплавляемых с повышенным содержанием углерода или выдержанных в натрии, насыщенном углеродом. Повышение содержания углерода в аустенитных сталях приводит к росту предела текучести, предела прочности и одновременному снижению пластичности. Получены эмпирические зависимости механических свойств при растяжении от содержания углерода при науглероживании в натрии образцов толщиной 0,5 мм. Например, для стали Х18Н10Т относительное удлинение при комнатной температуре и температуре 650 °C можно вычислить из эмпирических уравнений:
(4.12)
- где С — содержание углерода в стали, % (уравнение получено для концентраций 0,09—1,06%).
Предел прочности изменяется в меньшей степени:
![]() (4.14) (уравнение получено для концентраций 0,09—0,35 %).
(4.14) (уравнение получено для концентраций 0,09—0,35 %).

